Конструкционные полимерные материалы
Полиэтилен 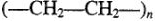
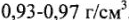
Полипропилен — это белая упругая масса с высокой температурой плавления (выше, чем у полиэтилена). В химическом отношении он стоек и нерастворим в органических растворителях. Полипропилен подвержен воздействию сильных окислителей, в течение длительного времени — кислорода. Из полипропилена изготавливают трубы, канаты, детали машин и приборов.
Полистирол (фенилэтилен или винилбензол) — прозрачная стеклообразная масса. Используется для различных деталей и для всевозможных изделий бытового назначения, электроизолятора. Полистирол бывает разных видов: прозрачный и непрозрачный. Прозрачный полистирол иногда при постукивании звенит, а пленка из полистирола дребезжит. Горит полистирол с обильным выделением копоти, распространяя резкий своеобразный запах.
Полиакрилаты — это продукты полимеризации метиловых эфиров акриловой и метаакрйловой кислотами. Полиметилакрилат — найболее прозрачная из всех пластмасс. Он пропускает ультрафиолетовые лучи. Горит голубым пламенеми, без копоти, с потрескиванием.
Каучуки. При полимеризации изопрена происходит перемещение двойной связи. Каучук содержится в млечном соке некоторых растений. Гутгаперча также является полимером изопрена, но с иной конфигурацией молекул. Сырой каучук липок, недостаточно прочен, а при небольшом понижении температуры становится хрупким. Производным для синтетического каучука служит бутадиен:
Синтетические каучуки по некоторым свойствам превосходят природный каучук.
Политетрафторэтилен — 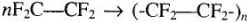
Поливинилхлорид — белая эластичная масса, очень стойкая к действию кислот и щелочей. Применяется для футеровки аппаратов химических производств, для изоляции электри
ческих проводов и как заменитель кожи для всевозможных изделий промышленного и бытового назначения.
Эпоксидные смолы — продукт полимеризации алкеноксидов. Так, оксаид этилена подвергается полимеризации по следующейсхеме:
Отвержденные эпоксидные смолы обладают хорошей устойчивостью к воздействию щелочей, моющих средств, окислителей и большинства неорганических кислот и слабо устойчивы к воздействию органических кислот и некоторых растворителей (кетоны, хлорированные углеводороды).
Эпоксидные смолы обладают прекрасной адгезией к металлам, стеклу, керамике, применяются для приготовления клеев, лаков,заливочных компаундов, в качестве связующего для наполненных и армированных пластиков. Их используют для изготовления пенопластов и т.д.
На основе полимеров, кроме резины, пластмассы и композиционных материалов, получают также волокна, пленки, лаки, клеи.
Волокна. Их получают путем продавливания растворов или расплавов полимеров через тонкие огверсгия (фильеры) в пластине с последущим затвердеванием. К волокнообразующим полимерам относятся полиамиды, полиакрилонитрилы и др.
Полимерные пленки. Их получают из расплавов полимеров методом нанесения растворов полимеров на движущуюся ленту, или методом каландрования полимеров. Пленки используют в качестве электроизоляционного и упаковочного материала, основы магнитных лент и т.д.
Лаки — растворы пленкообразующих веществ в органических растворителях. Кроме полимеров лаки содержат вещества, повышающие пластичность (пластификаторы), растворимые красители, отвердители и др. Применяются лаки для электроизоляционных покрытий, а также в качестве основы грунтовочного материала и лакокрасочных эмалей.
Клеи — композиции, способные- соединять различные материалы вследствие образования прочных связей между их поверхностями и клеевой прослойкой. Синтетические органические клеи составляются на основе мономеров, олигомеров, полимеров или их смесей.
В состав композиции входят отвердители, наполнители, пластификаторы и др. Клеи подразделяются на термопластические и термореактивные, резиновые. Термопластические клеи образуют связь с поверхностью в результате затвердевания при охлаждении от температуры текучести до комнатной температуры или испарения растворителя.
Композиционные материалы (композиты). Они состоят из полимерной основы, армированной наполнителем в виде высокопрочных волокон или нитевидных кристаллов. Армирующие волокна и кристаллы могут быть металлическими, полимерными, неорганическими (например: стеклянными, карбидными, борными, нитридными).
Армирующие наполнители в значительной степени определяют механические, теплофизические и электрические свойства полимеров. Многие композиционные полимерные материалы по прочности не уступают металлам. Композиты на основе полимеров, армированных стекловолокном (стеклопластики), обладают высокой механической прочностью и хорошими электроизоляционными свойствами.
Композиты на основе полимеров, армированных углеродными волокнами (углепластики), сочетают высокую прочность и вибропрочность с повышенной теплопроводностью и химической стойкостью. Боропластики (наполнители — борные волокна) имеют высокую твердость и низкую ползучесть.
Кремнийорганические полимеры (силиконы). Они содержат атомы кремния в элементарных звеньях макромолекул, например:
или
Характерными особенностями этих полимеров являются высокая тепло- и морозостойкость, эластичность. Кремнийорганические полимеры используются для получения лаков, клеев, пластмассы и резины. Кремнийорганические каучуки растворимы в углеводородах, галогеноуглеводородах, эфирах.
Вулканизируются с помощью органических пероксидов. Резины могут эксплуатироваться при температуре от -90 до 300 °C, обладают атмосферостойкостью, высокими электроизоляционными свойствами. Каучуки, например диметилсилоксановый и метилвинилсилоксановый, имеют плотность 0,96-0,98 г/см3, температуру стеклования 130 °C.
Кремнийорганические полимеры применяются для изделий, работающих в условиях большого перепада температур, например, для защиты покрытий космических аппаратов, холодильных аппаратов и т.д. Большой вклад в разработку кремнийорганических полимеров внес К. А.-Андрианов.
Капрон. Это поликонденсат аминокапроновой кислоты, содержащей цепь из шести атомов углерода:
Капрон плавится при температуре 216 °C. Загорается с трудом, горит голубоватым пламенем и быстро гаснет. При нагревании разлагается с выделением аммиака. Из расплавленного капрона можно вытянуть тонкие нити. Капрон устойчив к щелочам и разбавленным кислотам. В концентрированных кислотах растворяется.
Анид (нейлон или перлон). Получается поликонденсацией двухосновной адипиновой кислоты 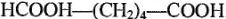
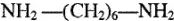
Все текстильные волокна, применяемые для производства различных видов пряжи, подразделяются на натуральные и химические. Натуральными называют волокна, образующиеся в растениях (хлопковое, льняное и другие волокна, состоящие из целлюлозы) или из выделений живых организмов (шерсть, шелковые нити, выделяемые тутовым шелкопрядом, состоящие из белков).
Химическими называют все волокна, которые производятся искусственным путем. Их в свою очередь подразделяют на искусственные, получаемые при химической переработке природных веществ (главным образом целлюлозы), и синтетические — изготовляемые из специально синтезируемых химических материалов.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Решение задач по химии
Возможно эти страницы вам помогут:
Органические соединения. реферат. химия. 2009-01-12
Оглавление.
Предельные углеводороды. (Алканы.).
Нонан. 2
Непредельные углеводороды (Алкены. Алкины).
Нонен-1. 4
Нонин-1 6
Спирты. Нониловый спирт. Нонанол-1. 8
Карбонильные соединения.
Альдегиды. Нонаналь.
10
Кетоны. Нонанон.
12
Список литературы.
14
Предельные углеводороды (Алканы)
Нонан.
Молекулярная формула:
C9Н20
Структурная формула:
CH3–CН2–СН2–СН2-СН2–СН2–СН2–СН2-СН3
Электронная формула:
Вид связи:
В молекуле нонана имеется 28 ( -связей, (- связи C-C и C-H с углами между связями 109,5°.
Образование связей:
В предельных углеводородах атомы углерода находятся в состоянии sp3-
Ггибридизации и способны образовывать 4 ( -связи каждый
Изомерия: У нонана проявляется только структурная изомерия. Общее число изомеров нонана- 35, например: а) CH3
|
CH3–C–CH2–CH2 CH2–CH3 б)
CH3–CH2–CH–CH2–CH2-CH3
| |
|
CH3 CH3
CH2–CH2-CH3
2,2,4триметилгексан.
3пропилгексан.
Нахождение в природе:
Нефть, природные и попутные нефтяные газы.
Получение:
1.Разгонка нефти.
2.Гидрогенизация бурых углей (Бергиус).
3.Синтез из окиси углерода (Ф. Фишер и Тропш)
4.Действие воды на металлоорганические соединения Li, Na, Mg, Zn:
C9H19Br Mg — C9H19MgBr
C9H19MgBr H2O — C9H20 MgBrOH
5.Восстановление при высокой температуре иодистоводородной кислотой производных алканов- галоид замещенных, спиртов, кислот:
Cl
H3C-CH-CH2-CH2-CH2-CH2-CH2-CH2-CH3 2HI > H3C-CH2-CH2-CH2-CH2-CH2-
CH2-CH2-CH3 HC3 I2
6.Гидрирование непредельных углеводородов:
Ni, t
CH3–CH2–CH2–CH2–CH2–CH2–CH2–CH=CH H2
>CH3–CH2–CH2–CH2–CH2–CH2–CH2–CH2–CH3
7.Реакция Вюрца:
C4H9-I 2Na I-C5H11 >C9H20
Физические свойства:
Нонан (в нормальных условиях) – жидкость. Т-плавления -53,7°C; Т- кипения 150,8°C. Практически не растворим в воде, хорошо растворим в неполярных растворителях (бензоле).
Является хорошим растворителем.
Химические свойства:
1.Окисление:
C9H20 14O2 >9CO2 10H2O
2.Реакция радикального галогенирования: nV t°C
C9H19-H Br2 > C9H19Br HBr а) Инициирование цепи
Br2 > Br- Br- б) Развитие цепи
C9H19-H Br- > C9H19- HBr
C9H19- Br2>C9H19Br Br- в) Обрыв цепи
C9H19- C9H19-> C9H19-C9H19
C9H19- Br-> C9H19-Br
Br- Br->Br-Br
3. Радикальное нитрование. Реакция Коновалова: t
4.Реакция изомеризации:
CH3
AlCl
|
CH3–CH2–CH2–CH2–CH2–CH2–CH2–CH2–CH3 > CH3–CH2–CH2 –CH –CH2 –CH2
–CH2 – CH3
5.Крекинг.
C9H20>C5H12 C4H8
Применение:
Парафины ценное высококалорийное топливо. Жидкие углеводороды, в частности нонан, в качестве горючего применяют в двигателях внутреннего сгорания в автомобилях, самолетах и др.
Непредельные углеводороды. (Алкены, Алкины.)
Нонен-1.
Молекулярная формула:
C9H18
Структурная формула:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH=CH2
Электронная формула:
Вид связи:
В молекуле нонена имеется 27 ( -связей и одна ?- связь. 3 (
-связи расположены в одной плоскости под углом 120° друг к другу.
Двойная связь является сочетанием ( и ? -связей.
Образование связей: sp2-Гибридизация атомов углерода, ?-связь образована p-электронами соседних атомов углерода.
Изомерия:
1) Изомерия углеродного скелета 2) Изомерия положения двойной связи 3)
Цис-транс изомерия
4) Межклассовая изомерия с циклоалканами. а) CH3-CH2-CH2-CH2-CH2-CH2-C=CH2
|
CH3
2метилоктен-1 б) CH3-CH2-CH=CH-CH2-CH2-CH2-CH2-CH3 нонен-3 в) C4H9 H C4H9 C3H7
C=C C=C
H C3H7 H
H цис-нонен-4 транс-нонен-4 г) Циклононан.
Нахождение в природе:
Нефть.
Получение:
1.Крекинг алканов:
C18H28>C9H18 C9H20
2. Элиминирование –отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними ?- связи.
а) Дегидрогалогенирование происходит при действии спиртовых растворов щелочей на моногалогениды:
C7H15-CH-Br-CH3 KOH>CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH=CH2 KBr H2O
б) Дегидратация спиртов (t>150°C):
C7H15-CH (OH)-CH3>CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH=CH2 в) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
C7H15-CHBr-CH2Br >C7H15-CH=CH2 MgBr2 г) Дегидрирование алканов при t-500°C:
Cr2O3
С9H20> C7H15-CH=CH2
Физические свойства:
Нонен (в нормальных условиях) –жидкость. Нонен не растворим в воде, хорошо растворим в органических растворителях.
Химические свойства:
Реакции присоединения протекают по электрофильному механизму.
1.Гидрогалогенирование:
C7H15-CH=CH2 HBr > C7H15-CHBr-CH3
2.Галогенирование. Нонен обесцвечивают бромную воду:
C7H15-CH=CH2 Br2 >C7H15-CHBr-CH2Br (качественная реакция на алкены)
3.Гидрирование: t,Ni
C7H15-CH=CH2 H2 >C7H15-CH2-CH3
4.Вода (в кислой среде) и кислоты присоединяются к декену по правилу Марковникова:
H
C7H15-CH=CH2 H2O >C7H15-CH-CH3
|
OH
C7H15-CH=CH2 H2SO4 >C7H15-CH-CH3
|
OSO3H
5.Окисление перманганатом калия в слабощелочной среде приводит к образованию гликолей (реакция Вагнера):
C7H15-CH=CH2 2KMnO4 4H2O > C7H15- CH- CH2 2KOH 2MnO2
| |
OH OH
6.Реакция полимеризации: n C7H15-CH=CH2 >(-CH2-CH-CH2-CH-)n
| |
C7H15 C7H15
Алкены, в частности нонен, благодаря своей доступности (крекинг нефти) и высокой и разнообразной реакционной способности служат в настоящее время главным сырьевым источником (наряду с ароматическими углеводородами и ацетиленом) для многообразных отраслей органической химической промышленности.
Нонин-1.
Молекулярная формула:
C9H16
Структурная формула:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-C?CH
Электронная формула:
Вид связи:
В молекуле нонина имеется 24 ( -связи и 2 ?- связи. 2 ( -связи располагаются по одной линии под углом 180° друг к другу. Две ?
–связи образованы p-электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях. Тройная связь является сочетанием ( и 2х ? -связей.
Образование связей:
Sp3-Гибридизация атомов углерода, Две ? –связи образованы p- электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях.
Изомерия:
1) Изомерия углеродного скелета 2) Изомерия положения тройной связи
3) Межклассовая изомерия с алкадиенами. а) CH3-CH2-CH2-CH2-CH2-CH-C?CH
|
CH3
3метилоктин-1 б) CH3-CH2-C?C-CH2-CH2-CH2-CH2-CH3 нонин-3 в) CH3-CH2-CH2-CH2-СH2-CH=CH-CH=CH2 нонадиен1,3
Нахождение в природе:
Нефть.
Получение:
1.Дегидрогалогенирование.
C5H11-CH2-CHBr2-C2H5 2KOH>C9H16 2KBr 2H2O
C5H11-CHBr-CHBr-C2H5 2KOH> C9H16 2KBr 2H2O
2. Удлинение цепи.
C5H11-CH3-C?CNa Br-CH3> C9H16 NaBr
Физические свойства:
Нонин (в нормальных условиях) –жидкость. Нонин плохо растворим в воде, лучше – в органических растворителях.
Химические свойства:
1. Реакции электрофильного присоединения протекают медленнее, чем для нонена. Продукты определяются правилом Марковникова. а) Галогенирование. Нонин обесцвечивает бромную воду:
Br2
Br2
C7H15-C?CH > C7H15-CBr=CHBr> C7H15-CBr2-CHBr2 б) Гидрогалогенирование:
HCl
HCl
C7H15-C?CH > C7H15-CCl=CH2 > C7H15-CCl2-CH3 в) Гидратация (реакция Кучерова) протекает в две стадии. На первой стадии образуется неустойчивый непредельный спирт, который затем изомеризуется в кетон.
Hg2 ,H
C7H15-C?CH Н2О -> [C7H15-C(OH)=CH2] > C7H15-CО-CH3
2. Реакции окисления и восстановления. а) Окисление перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
C7H15-C?CH 3[O] H2O > C7H15-COOH H-COOH б) Гидрирование при нагревании с металлическими катализаторами:
Н2
Н2
C7H15-C?CH > C7H15-CН=CH2 > C7H15-CН2-CH3
3. Качественные реакции на тройную связь – обесцвечивание бромной воды и раствора перманганата калия.
Применение:
В органическом синтезе.
Спирты.
Нониловый спирт.
Нонанол-1.
Молекулярная формула:
C9H19OH
Структурная формула:
CH3–CН2–СН2–СН2-СН2–СН2–СН2–СН2-СН2-OH
Электронная формула:
Электронная плотность:
С9H19>OCH3-CH2-CH2-CH2-CH2-CH2-CH2-
CH-CH3
|
OH
2. Гидролиз алкилгалогенидов под действием водных растворов щелочей.
C8H17-CH2Br NaOH>C8H17-CH2-OH NaBr
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, а кетонов – вторичные: а) C8H17-CH=O 2[H]>C8H17-CH2-OH б) C7H15-CO-CH3 2[H]>C7H15-CH(OH)-CH3
4. Действие реактивов Гриньяра R-MgBr на карбонильные соединения:
H2O
H2CO C8H17MgBr> C8H17-CH2-O-MgBr> C8H17-CH2-OH
-Mg (OH) Br
Физические свойства:
Нониловый спирт (в нормальных условиях) –жидкость. Нониловый спирт хорошо растворим в воде.
Химические свойства:
1.Реакции с разрывом связи O-H. а) Реакции со щелочными металлами:
H
CH3-CO-OH H-O-C9H19>CH3-CO-O-C9H19 H2O
Атом водорода отщепляется от спирта, а группа OH -от кислоты. в) Окисление спиртов под действием перманганата калия. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
[O]
[O]
C8H17-CH2-OH>C8H17-CH=O>C8H17-COOH
2.Реакции с разрывом связи C-O. а) Внутримолекулярная дегидратация с образованием алкенов:
H2SO4
CH3–CН2– CН2-СН2-СН2–СН2–СН2–СН2-СН2-OH>CH3–CН2– CН2-СН2–СН2-
СН2–СН2–СН=СН2 H2O
t(150(C б) Межмолекулярная дегидратация с образованием простых эфиров:
H2SO4
2C9H19OH>C9H19-O-C9H19 H2O t(150(C в) Слабые основные свойства проявляются в обратимых реакциях с галогеноводородами:
C9H19OH HBr>C8H17-CH2Br H2O
Применение:
Нонанол применяют в виде уксусного эфира в качестве растворителя, также используют в разнообразных органических синтезах.
Карбонильные соединения.
Альдегиды.
Нонаналь.
Молекулярная формула:
C9H18О
Структурная формула:
CH3–CН2–СН2–СН2-СН2–СН2–СН2–СН2-СН=O
Электронная формула:
Электронная плотность:
?
C8H17>С>O
^
Н
Вид связи:
В молекуле нонаналя имеется 28 ( -связей, (- связи C-C , C-H и C=O с углами между связями 109,5° и одна ? –связь С-О.
Образование связей:
В альдегидах атомы углерода находятся в состоянии sp3-гибридизации и способны образовывать 4 ( -связи каждый.
Изомерия:
1) Изомерия углеродного скелета 2) Межклассовая изомерия с кетонами. а) CH3-CH2-CH2-CH2-CH2-CH-CH2-CH=O
|
CH3
3метилоктаналь б) CH3–CН2–СН2–СН2-СН2–С–СН2–СН2-CH3
||
O нонанон4
Нахождение в природе:
В виде различных соединений.
Получение:
1. Окисление первичных спиртов:
C8H17-CH2-OH CuO> C8H17-СH=O Cu H2O
2. Гидролиз дигалогеналканов:
C8H17-СHCl2 NaOH> C8H17-СH=O 2NaCl H2O
Физические свойства:
Нонаналь (в нормальных условиях) –легкокипящая жидкость. Нонаналь хорошо растворим в воде.
Химические свойства:
1. Реакции нуклеофильного присоединения по двойной связи C-O.
KCN
а) С8Н17-СН=O HCN -> C8H17-CH-CN
|
OH б) Присоединение реактива Гриньяра приводит к вторичным спиртам:
H2O
С8Н17-СН=O R’-MgBr > С8Н17-CН-O-MgBr ———> С8Н17-CН-OH
| -Mg(OH)Br
|
R’
R’ в) Гидрирование:
С8Н17-СН=O Н2 > С8Н17-CH2-ОН г) Присоединение спиртов:
OH
H
|
С8Н17-СН=O R’OH? С8Н17-HC
|
OR’
OR’
2H=
С8Н17-СН=O 2R’OH ? С8Н17-HC
|
OR’ д) Присоединение гидросульфитов:
O O
||
||
C8H17-CH=O :S-ONa>C8H17-CH-S-ONa
|
| ||
OH HO O
2. Окисление: а) Реакция «серебряного зеркала»
С8Н17-СН=O 2[Ag(NH3)2]OH > С8Н17COONH4 2Agv 3NH3 H2O б) С8Н17-СН=O 2Cu(OH)2.> С8Н17-COOН Cu2Ov 2H2O
3. Реакция полимеризации:
Применение:
Синтез многих органических веществ.
Кетоны.
Нонанон-1.
Молекулярная формула:
C9H18О
Структурная формула:
CH3–CН2–СН2–СН2-СН2–СН2–СН2–С-CH3
||
O
Электронная формула:
Электронная плотность:
CH3–CН2–СН2–СН2-СН2–СН2–СН2>С C7H15-CO-CH3
|
OH
2. Гидратация алкинов:
Hg2 , H
C7H15-C?CH H2O—> [C7H15-C(OH)-CH2] > C7H15-CO-CH3
3. Декарбоксилирование кальциевых солей карбоновых кислот: t
Ca(C9H19COO)2 >CaCO3 C7H15-CO-CH3
4. Гидролиз дигалогеналканов:
C7H15-CBr2-CH3 2NaOH > C7H15-CO-CH3 2NaBr H2O
Физические свойства:
Нонанон (в нормальных условиях) –легкокипящая жидкость. Нонанон с повышением молекулярной массы растворимость кетонов падает, поэтому нонанон растворяется немного медленнее.
Химические свойства:
1. Реакции нуклеофильного присоединения по двойной связи C-O.
Нонанон менее активен, чем нонаналь:
CN
KCN
| а) C7H15-CO-CH3 HCN -> C7H15-C-СН3
|
OH б) Присоединение реактива Гриньяра приводит к третичным спиртам:
CH3
CH3
| H2O
|
C7H15-CO-CH3 R’-MgBr > C7H15-C-O-MgBr ———> C7H15-C-OH
| -Mg(OH)Br
|
R’
R’ в) Гидрирование приводит к вторичным спиртам:
C7H15-CО-CH3 Н2 > C7H15-CH-CH3
|
ОН г) Присоединение воды с образованием гидратных форм:
OH
|
C7H15-CО-CH 3 H-OH ? C7H15-C-CH3
|
OH
2. Окисление:
Нонанон окисляется гораздо труднее, чем нонаналь, и при жёстких условиях. Не реагируют с [Ag(NH3)2]OH и Cu(OH)2.
Применение:
Нонанон используется в производстве синтетических волокон, а также служит сырьём для производства фармацевтических препаратов.
Список литературы.
Серия «Справочники «Дрофы»». Е.А.Ерёмина. В.В.Ерёмин.
Н.Е.Кузьменко. «Химия 8-11 кл.»
Издательство «Дрофа». Москва 1996 г.
Издательство «Просвещение». Москва 1993 г.
———————–
[pic]
[pic]
–??/???†?????????????–??/???†???–??/???†???
[pic]
[pic]
[pic]
[pic]
Синтетическая органическая химия
Красители
Первая половина XIX в. ознаменовалась развитием новой области химии — синтетической органической химии . Химики вслед за Бертло (см. гл. 6) начали соединять в цепи органические молекулы. Недостаточное понимание строения молекул мешало химикам-органикам середины XIX в., но прогресс науки настолько неотвратим, что этот недостаток, по крайней мере в одном знаменательном эпизоде, оказался преимуществом.
В то время (40-е годы прошлого века) в Великобритании было немного известных химиков-органиков, и работавший у Либиха (см. гл. 6) Август Вильгельм Гофман (1812—1892) был приглашен в Лондон из Германии. Спустя несколько лет Гофман взял к себе в качестве помощника совсем еще юного Уильяма Генри Перкина (1838—1907). В то время Гофман исследовал химические вещества, получаемые из каменноугольного дегтя (густой черной жидкости, образующейся при нагревании каменного угля без доступа воздуха). Однажды Гофман в присутствии Перкина начал рассуждать вслух о возможности синтеза хинина — ценного лекарственного средства против малярии — из каменноугольного дегтя. Если бы синтез хинина удался, Европа избавилась бы от зависимости от поставщиков хинина, привозивших его из далеких тропиков.
Загоревшись этой идеей, Перкин сразу же принялся за дело (дома у него была своя небольшая лаборатория). Если бы он или Гофман больше знали о строении молекулы хинина, то они поняли бы, что эту задачу нельзя решить, основываясь на методах химии середины XIX в. К счастью, Перкин был относительно этого в блаженном неведении, и хотя ему не удалось синтезировать хинин, он достиг, возможно, большего.
Во время пасхальных каникул 1856 г. Перкин, пропадая в лаборатории, обработал анилин бихроматом калия и, разочарованный результатом, уже собрался было выбросить полученную массу, как вдруг заметил, что она приобрела пурпурный оттенок. Перкин добавил спирт, который извлек из реакционной смеси вещество, окрасившее спирт в великолепный пурпурный цвет.
Перкин понял, что у него в руках краситель. Он бросил учебу и на деньги своей семьи построил фабрику. Уже через шесть месяцев фабрика начала выпускать то, что Перкин назвал «анилиновым пурпуром». Новый краситель очень понравился французским красильщикам, они назвали его сиреневым, и этот цвет сделался настолько популярным, что связанный с ним период истории известен как «сиреневое десятилетие». Перкин, первым организовавший промышленное производство синтетического красителя , разбогател и в тридцать пять лет смог отойти от дел.
Несколько лет спустя после поразительного успеха Перкина химики познакомились со структурными формулами органических соединений. Эти формулы могли служить химикам своего рода картой «территории», на которой им предстояло действовать. Используя эту карту, можно было вывести логические схемы реакций, подобрать методы, позволяющие, постепенно меняя строение молекул, превратить одну молекулу в другую и, наконец, синтезировать новые органические соединения не случайно, как это вышло у Перкина, а целенаправленно.
Часто реакциям присваивали имя их первооткрывателя. Так, способ добавления двух атомов углерода в молекулу, открытый Перкином, был назван реакцией Перкина , а способ расщепления гидроокисей четвертичных аммониевых оснований с образованием третичного амина и олефина, открытый учителем Перкина, был назван реакцией Гофмана .
Гофман вернулся в Германию в 1864 г. и занялся там синтетической органической химией — новой областью химии, в которой так успешно проявил себя его юный ученик Перкин. И, в частности, благодаря работам Гофмана синтетическая органическая химия оставалась вплоть до первой мировой войны почти полной монополией Германии.
В лабораториях осуществлялся синтез природных красителей. В 1867 г. Адольф Байер (автор теории напряжений) начал осуществление плана исследований, которые в итоге привели его к синтезу индиго . (Ранее индиго получали из индигоносных растений, крупные плантации которых расположены на Дальнем Востоке и в Южной Азии.) В 1868 г. ученик Байера Карл Гребе (1841—1927) синтезировал другой важный природный краситель — ализарин .
Эти и подобные им достижения заложили основы теории и технологии прикладной химии, благодаря успехам которой наша жизнь преобразилась столь значительным образом за последние несколько десятилетий и продолжает преображаться в еще более ускоренном темпе.
Вплоть до настоящего момента мы последовательно излагали факты, четко следуя за развитием событий, но в этой и следующей главах мы рассмотрим несколько отдельных достижений, благодаря которым химия начала служить человечеству. При этом мы несколько отклонимся от главного пути развития химии. В последующих трех главах мы вновь вернемся к принятой нами схеме изложения.
Лекарственные средства
Вслед за Перкином химики начали синтезировать соединения все возрастающей сложности. Конечно, синтетические соединения в то время не могли конкурировать с природными [87], однако существовало несколько исключений, в частности синтетический индиго. Кроме того, синтез обычно позволял установить молекулярное строение, что всегда представляло огромный теоретический (а иногда и практический) интерес.
Так, немецкий химик Рихард Вильштеттер (1872—1942) тщательно определил строение хлорофилла — зеленого пигмента растений, который позволяет использовать энергию солнечного света при превращении растениями углекислого газа в углеводы.
Два немецких химика, Генрих Отто Виланд (1877—1957) и Адольф Виндаус (1876—1959), определили строение стероидов и родственных им соединений. (К числу стероидов относится ряд важных гормонов.) Еще один немецкий химик, Отто Баллах (1847—1931), установил строение терпенов — практически важных растительных масел, а его соотечественник Ганс Фишер (1881—1945) установил строение гема — красящего вещества крови.
В XX в. проводилось исследование витаминов, гормонов, алкалоидов, и во многих случаях строение их молекул было установлено. Например, в 30-х годах нашего столетия швейцарский химик Пауль Каррер (1889—1971) определил строение каротиноидов — важных растительных пигментов.
Английский химик Роберт Робинсон (1886—1975) систематически изучал алкалоиды. Наибольший успех ему принесли работы по определению строения морфина (1925 г.) и стрихнина (1946 г.). Последняя работа Робинсона была подкреплена работой американского химика Роберта Бернса Вудворда (1917—1979), который в 1954 г. синтезировал стрихнин. Вудворд завоевал признание как химик-синтетик после того, как он и его американский коллега Уильям Эггерс Дёринг (род. в 1917 г.) в 1944 г. синтезировали хинин — то самое соединение, за которым вслепую охотился Перкин (правда, эта «охота» в конце концов принесла ему огромные доходы).
В последующие годы Вудворд продолжал заниматься синтезом и получил ряд соединений все более и более сложной структуры. Так, в 1951 г. он синтезировал холестерин (наиболее известный из стероидов) и кортизон (стероидный гормон), в 1956 г.— резерпин (первый из транквилизаторов) а в 1960 г.— хлорофилл . В 1962 г. Вудворд [88] синтезировал сложное соединение — производное хорошо известного антибиотика тетрациклина [89].
Американский химик (уроженец России) Фебус Аарон Теодор Левин (1869—1940) работал в другом направлении. Он изучал строение нуклеотидов — тех блоков, из которых построены гигантские молекулы нуклеиновых кислот. (В настоящее время установлено, что нуклеиновые кислоты управляют химическими процессами, протекающими в организме человека.) Правильность выводов Левина полностью подтвердили результаты работы шотландского химика Александра Робертуса Тодда (род. в 1907 г.), который в 40-х — начале 50-х годов нашего века синтезировал ряд нуклеотидов и родственных им соединений.
Некоторые из этих соединений, в частности алкалоиды, применяются в медицине и, следовательно, попадают под общую рубрику лекарственные средства . В самом начале XX в. было показано, что ряд синтезированных соединений может использоваться в медицине как лекарственные средства.
В 1909 г. немецкий бактериолог Пауль Эрлих (1854—1915) применил при лечении сифилиса синтетическое соединение сальварсан . Таким образом было положено начало исследованиям в области химиотерапии — лечения болезней с применением специальных химических препаратов.
В 1908 г. было синтезировано соединение, названное сульфаниламидом (аминобензолсульфамид), которое пополнило обширный ряд синтетических соединений, не нашедших применения. Однако в 1932 г. благодаря исследованиям немецкого химика Герхарда Домагка (1895—1964) было установлено, что сульфаниламид и некоторые родственные ему соединения можно использовать для лечения ряда инфекционных заболеваний. Правда, в этой области природные соединения оказались более эффективными, чем синтетические. Примером тому может служить пенициллин — первый антибиотик, который был случайно открыт в 1928 г. шотландским бактериологом Александром Флемингом (1881—1955). Флеминг оставил на несколько дней открытой культуру стафилококковых бактерий, а затем обнаружил, что она покрылась плесенью. Внимательно разглядывая плесень, Флеминг увидел, что вокруг каждого пятнышка плесени располагаются «чистые» области, где культура бактерий исчезла. Флеминг на уровне своего времени изучил этот факт и предположил, что в этих «чистых» областях присутствует соединение с сильным антибактериальным действием, однако выделить это соединение оказалось непростым делом.
В связи с острой необходимостью в лекарственных средствах, необходимых для борьбы с инфекционными заболеваниями, во время второй мировой войны интерес к такого рода соединениям значительно возрос, и этой проблемой начали заниматься более обстоятельно.
Группе ученых под руководством английского биохимика-патолога (уроженца Австралии) Хоуарда Уолтера Флори (1898—1968) и английского биохимика (уроженца Германии) Эрнста Бориса Чейна (род. в 1906 г.) удалось выделить пенициллин и определить его строение. К 1945 г. была разработана технология получения пенициллина с использованием культуры плесени, которая позволяла получать полтонны продукта в месяц.
В 1958 г. химики научились «снимать» с готового пенициллина бензильную группу и присоединять взамен нее другие органические группы. Некоторые из этих полусинтетических веществ, не имеющих аналогов среди природных соединений, обладали более высокой антибактериальной активностью, чем сам пенициллин. Между 40-ми и 50-ми годами из различных видов микроорганизмов были выделены и другие антибиотики, в частности стрептомицин.
В ходе синтеза сложных органических соединений необходимо время от времени проводить анализ с целью идентификации продуктов, образующихся на разных стадиях процесса. Количество вещества, которое можно было бы отобрать для анализа, как правило, весьма невелико, и поэтому анализ в лучшем случае давал неточные результаты, а в худшем и вовсе был невозможен.
Австрийский химик Фриц Прегль (1869—1930) удачно модифицировал оборудование, используемое при анализе, уменьшив его размеры. Он создал особо точные весы, сконструировал образцы тонкой стеклянной посуды, а к 1913 г. разработал методику микроанализа . С этого времени анализ малых проб стал точным.
Классическими методами анализа обычно называют определение объема вещества, расходуемого при реакции (объемный анализ , иначе титриметрический анализ ), или массы вещества, полученного в результате реакции (весовой анализ , иначе гравиметрический анализ ). В XX в. были разработаны новые, физические, методы анализа, а именно измерение поглощения света, изменения электрической проводимости и другие более тонкие и более сложные методы [90].
Белки
Почти все органические соединения, перечисленные в предыдущем разделе, состоят из молекул, количество атомов в которых чаще всего не превышает пятидесяти; эти атомы с трудом распадаются в условиях умеренной химической обработки. Однако существуют органические соединения с поистине гигантскими молекулами, построенными из тысяч и даже миллионов атомов. Эти молекулы состоят из сравнительно небольших «строительных блоков» [91]. Такие гигантские молекулы легко разложить на образующие их блоки, которые можно исследовать. Так, например, поступил Левин, изучая нуклеотиды (см. предыдущий раздел). Предпринимались также попытки изучать эти гигантские молекулы как таковые, не разрушая их предварительно. Первые шаги в этом направлении предпринял шотландский химик Томас Грэхем (1805—1869). Заинтересовавшись диффузией — движением частиц среды, приводящим к переносу вещества и выравниванию концентраций, он начал изучать диффузию газов через мельчайшие поры или тонкие трубки. В 1829 г. ему удалось показать, что скорость диффузии газа обратно пропорциональна корню квадратному из его плотности (закон Грэхема ).
Далее Грэхем перешел к изучению диффузии растворенных веществ. Он обнаружил, что растворы веществ, подобных соли, сахару или сульфату меди, проходят через разделяющую перегородку из пергаментной бумаги (имеющей, как он предполагал, микроскопические поры). В то же время растворы таких соединений, как гуммиарабик, животный клей и желатина, пройти через разделяющую перегородку не могут — очевидно, молекулы соединений последней группы для этого слишком велики.
Соединения, способные проходить через поры пергамента (и, как выяснилось, легко кристаллизующиеся), Грэхем назвал кристаллоидами . Соединения другой группы, не способные, подобно животному клею (по-гречески κόλλα). проходить через поры пергамента, он назвал коллоидами . Наука о гигантских молекулах стала впоследствии важным разделом коллоидной химии , которой, таким образом, Грэхем положил начало [92].
Предположим, что с одной стороны разделяющей перегородки находится чистая вода, а с другой — коллоидный раствор. Молекулы воды могут свободно проникать через перегородку в оба отсека. В первый момент в отсек с коллоидным раствором будет попадать большее число молекул воды, чем покидать его, поскольку выравнивание концентраций по обе стороны перегородки — самопроизвольный энергетически выгодный процесс. Суммарный поток молекул воды в отсек с коллоидным раствором будет продолжаться до тех пор, пока возникающая разность давлений жидкости с обеих сторон перегородки не достигнет определенной величины. Величина этого давления, приводящего к вынужденному равновесию, называется осмотическим давлением раствора .
В 1877 г. немецкий ботаник Вильгельм Пфеффер (1845—1920) показал, как можно измерить осмотическое давление и как, исходя из полученных результатов, можно определить молекулярную массу больших молекул, образующих коллоидные растворы. Это был первый удачный метод оценки размера таких молекул.
В 1923 г. шведский химик Теодор Сведберг (1884—1971) сконструировал центрифугу и разработал седиментационный метод определения молекулярной массы макромолекул, главным образом белков.
Ассистент Сведберга Арне Вильгельм Каурин Тиселиус (1902—1971), также швед, в 1923 г. разработал более совершенный метод разделения гигантских молекул, основанный на характере распределения электрического заряда по поверхности молекулы. Этот способ — электрофорез — оказался особенно важным при разделении и очистке белков.
С помощью физических методов химики могли получить представление об общей структуре гигантских молекул, однако они стремились установить детальное строение этих соединений. Особый интерес вызывали у них белки.
В то время как гигантские молекулы таких веществ, как крахмал или клетчатка древесины, построены из одного многократно повторяемого блока, молекула белка строится из двадцати различных, но тесно связанных блоков — различных аминокислот (см. гл. 6). Именно по этой причине молекулы белков так разнообразны, но это же создает большие трудности при попытке их характеризовать.
Эмиль Фишер, который ранее установил детальное строение молекул сахаров (см. гл. 7), в начале нашего века обратил внимание на молекулу белка [93]. Он показал, что аминогруппа одной аминокислоты связана с остатком молекулы другой кислоты пептидной связью . В 1907 г. Фишер получил соединение, объединяющее восемнадцать аминокислот, и показал, что оно обладает рядом свойств, характерных для белков.
Однако определить порядок аминокислот в полипептидной цепи молекулы природного белка удалось лишь полстолетия спустя, после того как был разработан еще один метод анализа.
Открыл этот метод русский ботаник Михаил Семенович Цвет (1872—1919). Исследуя пигменты растений, Цвет пропустил раствор смеси очень мало различающихся по цвету пигментов через трубку, заполненную адсорбентом — порошкообразным карбонатом кальция, и промыл затем адсорбент чистым растворителем. Отдельные компоненты смеси при этом разделились и образовали цветные полосы. Цвет опубликовал статью с описанием открытого им метода разделения, который он назвал хроматографией («цветописью») [94].
Статья русского ученого осталась незамеченной, но в 20-е годы Вильштеттер (см. разд. «Лекарственные средства») и его ученик, немецкий химик (австриец по происхождению) Рихард Кун (1900—1967), вновь открыли этот способ разделения. В 1944 г. английские химики Арчер Джон Портер Мартин (род. в 1910 г.) и Ричард Лоуренс Миллингтон Синг (род. в 1914 г.) предложили новый вариант этого метода: они заменили трубку с адсорбентом на фильтровальную бумагу. Анализируемая смесь распределялась по фильтровальной бумаге, и компоненты смеси при этом разделялись. Этот способ был назван бумажной хроматографией .
В конце 40-х — начале 50-х годов нашего века химикам удалось обстоятельно проанализировать с помощью метода бумажной хроматографии смеси аминокислот, полученные при расщеплении ряда белков. В результате удалось установить общее число остатков каждой аминокислоты, содержащихся в молекуле белка, однако порядок расположения аминокислот в полипептидной цепи при этом определить, естественно, было нельзя. Английский химик Фредерик Сенгер (род. в 1918 г.) изучал инсулин — белковый гормон, состоящий примерно из пятидесяти аминокислот, распределенных между двумя взаимосвязанными полипептидными цепями. Сенгер расщепил молекулу на несколько более коротких цепей и проанализировал каждую из них методом бумажной хроматографии. Восемь лет продолжалась кропотливая работа по «складыванию мозаики», но к 1953 г. был установлен точный порядок расположения аминокислот в молекуле инсулина. Позднее таким же способом было установлено детальное строение даже больших молекул белка [95].
Следующий шаг состоял в том, чтобы подкрепить этот труд реальным синтезом заданной молекулы белка. В 1954 г. американец Винсент Дю-Виньо (1901—1978) положил начало такому синтезу. Он получил окситоцин — пептид, состоящий всего лишь из восьми аминокислотных остатков. Однако с более сложными молекулами дело пошло быстрее, и вскоре были синтезированы цепи, содержащие несколько десятков аминокислот. К 1963 г. в лабораторных условиях были получены полипептидные цепи инсулина.
Однако, зная только порядок расположения аминокислот, нельзя еще представить себе совершенно отчетливо все уровни организации белковой молекулы. Даже при осторожном нагревании белки нередко необратимо утрачивают свойства, присущие им в природном состоянии, иными словами, происходит денатурация белков. Причем обычно денатурация не сопровождается расщеплением полипептидной цепи; чтобы расщепить цепь, нужны более жесткие условия. Следовательно, цепи образуют какую-то определенную структуру под действием слабых «вторичных связей». В образовании таких вторичных связей обычно участвует атом водорода, находящийся между атомами азота и кислорода. Такая водородная связь в двадцать раз слабее обычной валентной связи.
В начале 50-х годов американский химик Лайнус Полинг (род. в 1901 г.) предположил, что полипептидная цепь свернута в спираль (подобна «винтовой лестнице») и удерживается в этом положении водородными связями. Эта идея оказалась особенно плодотворной применительно к относительно простым фибриллярным белкам , из которых состоят покровные и соединительные ткани.
Более того, спирали образуют даже более сложные по структуре глобулярные белки . Английские химики Макс Фердинанд Перутц (уроженец Австрии) (род. в 1914 г.) и Джон Коудери Кендрю (род. в 1917 г.) обнаружили это при детальном исследовании строения гемоглобина и миоглобина (белков крови и мышц соответственно, способных обратимо присоединять кислород). В своей работе они использовали новый метод анализа — метод дифракции рентгеновских лучей : пучок рентгеновских лучей, проходящий через кристаллы, рассеивается атомами, образующими кристаллы. Рассеивание в заданном направлении и при заданном угле наиболее эффективно в том случае, когда атомы располагаются последовательно. Определяя величину отклонения, можно выявить расположение атомов внутри молекулы. Исследовать таким образом большие молекулы сложной структуры, подобные белковой молекуле,— задача весьма трудоемкая, и тем не менее к 1960 г. таким образом удалось уточнить последние детали строения молекулы миоглобина (состоящей из двенадцати тысяч атомов).
Полинг считал, что предложенную им спиральную модель молекулы можно распространить и на нуклеиновые кислоты. В начале 50-х годов английский физик Морис Хью Фредерик Уилкинс (род. в 1916 г.) изучал нуклеиновые кислоты методом дифракции рентгеновских лучей, и результаты его работы можно было использовать для проверки справедливости предположения Полинга. Английский физик Фрэнсис Гарри Комптон Крик (род. в 1916 г.) и американский химик Джеймс Дьюи Уотсон (род. в 1928 г.) установили, что удовлетворительно объяснить результаты дифракционных исследований можно, лишь несколько усложнив модель молекулы. Каждая молекула нуклеиновой кислоты должна представлять собой двойную спираль, образованную навитыми вокруг общей оси цепями. Эта модель Уотсона — Крика, предложенная ими впервые в 1953 г., сыграла важную роль в развитии генетики [96][97].
Взрывчатые вещества
Не избежали молекулы-гиганты и преобразующей руки химика. Произошло это вначале случайно. В 1845 г. швейцарский химик Христиан Фридрих Шенбайн (1799—1868), уже прославивший себя открытием озона (аллотропной модификации кислорода), проводил опыты в своей домашней лаборатории. Разлив смесь азотной и серной кислот, он вытер эту смесь хлопчатобумажным фартуком и повесил его сушиться над печкой. Как только фартук высох, раздался несильный взрыв и фартука не стало. Сам того не зная, Шенбайн превратил целлюлозу фартука в нитроцеллюлозу [98]. Нитрогруппы (перешедшие из азотной кислоты) послужили внутренним источником кислорода, и при нагревании целлюлоза сразу же полностью окислилась.
Шенбайн понял важность сделанного им открытия. Обычный черный порох при взрыве дает много дыма, покрывает сажей артиллеристов, загрязняет пушки и стрелковое оружие, а на основе нитроцеллюлозы (нитроклетчатки) можно было получить «бездымный порох».
Однако наладить производство нитроклетчатки для военных целей долгое время не удавалось: фабрики, как правило, взрывались. Только в 1891 г. Дьюару (см. гл. 9) и английскому химику Фредерику Аугустусу Абелю (1872—1902) удалось получить безопасную смесь. Поскольку эту смесь можно было прессовать в длинные шнуры, ее назвали кордитом .
В состав кордита кроме нитроклетчатки входит также нитроглицерин , который был получен в 1847 г. итальянским химиком Асканио Собреро (1812—1888). Это мощное бризантное взрывчатое вещество отличается очень высокой чувствительностью, и использовать его как таковое в военных целях оказалось невозможным. Однако, невзирая на чрезвычайную опасность работы с большими количествами этого соединения, его стали применять при прокладке дорог в горах.
Производством нитроглицерина занялось семейство шведского изобретателя Альфреда Бернарда Нобеля (1833—1896). Когда в результате взрыва погиб брат Нобеля, он сосредоточил свои усилия на «усмирении» этого взрывчатого вещества. В 1866 г. Нобель обнаружил, что кизельгур может впитывать значительные количества нитроглицерина. Пропитанный нитроглицерином кизельгур можно было формовать в брикеты. Такие брикеты были совершенно безопасны в обращении, хотя пропитывающий кизельгур нитроглицерин сохранял свою разрушительную силу. Нобель назвал полученную им смесь динамитом .
Получение новых и более мощных по сравнению с черным порохом (изобретенным более пяти столетий назад) взрывчатых веществ в конце XIX в. положило начало гонке вооружений. Его применение для военных целей, как и разработка отравляющих газов во время первой мировой войны, отчетливо продемонстрировало, что задачи науки можно извратить и заставить ее служить целям разрушения. Еще более наглядный урок преподало изобретение самолета и в конечном счете ядерного оружия (см. гл. 14). Наука, которая до конца XIX в. казалась средством создания на земле утопии, стала служить уничтожению.
Полимеры
Однако существует много направлений, позволяющих использовать молекулы-гиганты в мирных целях. Так, если полностью нитрованная целлюлоза — это взрывчатое вещество и может применяться только как таковое, то частично нитрованная целлюлоза (пироксилин ) более безопасна в обращении, и ее можно применять не только в военных целях.
Американский изобретатель Джон Уэсли Хайятт (1837—1920), пытаясь завоевать приз, установленный за создание заменителя слоновой кости для биллиардных шаров, прежде всего обратил внимание именно на частично нитрованную целлюлозу. Он растворил ее в смеси спирта и эфира, добавил камфору, чтобы новое вещество легче было обрабатывать. К 1869 г. Хайятт получил то, что он назвал целлулоидом , и завоевал приз [99]. Целлулоид был первой синтетической пластмассой — материалом, который можно отливать в формы [100].
Однако, как выяснилось, частично нитрованную целлюлозу можно не только формовать в шары, но и вытягивать в волокна и пленки. Французский химик Луи Мари Гиляр Берниго, граф Шар-донне (1839—1924), получил такие волокна, продавливая раствор нитроцеллюлозы через тончайшие отверстия. Растворитель при этом почти сразу же испарялся.
Из полученных волокон можно было ткать материал, который своим блеском напоминал шелк. В 1884 г. Шардонне запатентовал полученный им искусственный шелк . Шардонне назвал эту ткань рейон — излучающая свет, так как ткань блестела и казалось, что она излучает свет.
Появлением пластмассовых пленок мы обязаны американскому изобретателю Джорджу Истмену (1854—1932). Истмен увлекался фотографией. Пытаясь упростить процесс проявления, он начал смешивать эмульсию соединений серебра с желатиной, чтобы сделать эту эмульсию сухой. Полученную таким образом смесь можно было хранить, а следовательно, и готовить впрок. В 1884 г. Истмен заменил стеклянные пластинки на целлулоидные.
Целлулоид невзрывоопасен, но он легко воспламеняется, что может быть причиной пожара, поэтому Истмен начал поиски менее горючих материалов. Когда в целлюлозу вместо нитрогрупп ввели ацетильные группы, полученный продукт остался столь же пластичным, как и нитроцеллюлоза, но он уже не был легко воспламеняющимся. С 1924 г. ацетилцеллюлозные пленки начали использовать в производстве кинофильмов, так как развивающаяся кинопромышленность особенно остро нуждалась в заменителе целлулоида.
Изучая высокомолекулярные природные соединения, химики рассчитывали не только получить их синтетические аналоги, но и открыть новые типы соединений. Одним из методов синтеза молекул-гигантов является полимеризация мономеров (мономер — вещество, молекулы которого способны реагировать между собой или с молекулами других веществ с образованием полимера).
Способ объединения мономеров в гигантскую молекулу можно пояснить хотя бы на примере этилена С2Н4. Напишем структурные формулы двух молекул этилена:
Представим себе, что атом водорода переместился из одной молекулы в другую, в результате в этой молекуле вместо двойной связи появилась свободная одинарная связь. Свободная связь появилась и у первой молекулы, из которой ушел водород. Поэтому эти две молекулы могут соединиться друг с другом.
Такая молекула содержит уже четыре углеродных атома и одну двойную связь, как и молекула исходного этилена. Следовательно, при взаимодействии этой молекулы с еще одной молекулой этилена также может произойти перемещение атома водорода и разрыв двойной связи. Образующаяся в результате молекула будет содержать шесть атомов углерода и одну двойную связь. Таким способом можно получить последовательно молекулу с восемью, десятью и более атомами углерода. Фактически так можно получать молекулы почти любой заданной длины.
Американский химик Лео Хендрик Бакеланд (1863—1944) искал заменитель шеллака — воскоподобного вещества, выделяемого некоторыми видами тропических насекомых. Для этой цели ему необходим был раствор клейкого дегтеобразного вещества. Бакеланд начал с того, что провел полимеризацию фенола и формальдегида и получил полимер, для которого не смог подобрать растворитель. Этот факт привел его к мысли, что такой твердый, практически нерастворимый и, как выяснилось, не проводящий электричество полимер может оказаться ценным материалом. Так, например, из него можно отливать детали, которые легко будет обрабатывать на станках. В 1909 г. Бакеланд сообщил о полученном им материале, который он назвал бакелит . Эта фенолформальдегидная смола была первой синтетической пластмассой [101], которая по ряду свойств осталась непревзойденной.
Нашли применение и синтетические волокна. Это направление возглавил американский химик Уоллес Хьюм Карозерс (1896—1937). Вместе с американским химиком Джулиусом Артуром Ньюлендом (1878—1936) он исследовал родственные каучуку [102]эластомеры . Результатом его работ было получение в 1932 г. неопрена — одного из синтетических каучуков [103].
Продолжая изучение полимеров, Карозерс попытался полимеризовать смесь диаминов и дикарбоновых кислот и получил волокнистый полимер. Длинные молекулы этого полимера содержат комбинации атомов, подобные пептидным связям (см. разд. «Белки») в белке шелка. Вытягивая эти волокна, получают то, что мы сегодня называем найлоном . Карозерс завершил эту работу буквально накануне преждевременной смерти. Разразившаяся вторая мировая война заставила химиков на время забыть об открытии Карозерса. Однако после окончания войны найлон начал вытеснять шелк и вскоре пришел ему на смену (в частности, в производстве чулочного трикотажа).
Первые синтетические полимеры были получены, как правило, случайно, методом проб и ошибок, поскольку и о строении молекул-гигантов, и о механизме полимеризации было в ту пору мало что известно. Первым за изучение строения полимеров взялся немецкий химик Герман Штаудингер (1881—1965) и сделал в этой области немало. Штаудингеру удалось раскрыть общий принцип построения многих высокомолекулярных природных и искусственных веществ и наметить пути их исследования и синтеза. Благодаря работам Штаудингера выяснилось, что присоединение мономеров друг к другу может происходить беспорядочно и приводить к образованию разветвленных цепей, прочность которых значительно ниже.
Начались интенсивные поиски способов получения линейных неразветвленных полимеров. И в 1953 г. немецкий химик Карл Циглер (1898—1973) открыл свой знаменитый титан-алюминиевый катализатор, на котором был получен полиэтилен с регулярной структурой.
Итальянский химик Джулио Натта (1903—1979) модифицировал катализатор Циглера и разработал метод получения нового класса синтетических высокомолекулярных соединений — стерео-регулярных полимеров [104]. Был разработан метод получения полимеров с заданными свойствами.
Одним из главных источников основных органических соединений, необходимых для производства новых синтетических продуктов, является нефть . Эта жидкость известна с античных времен, но чтобы использовать ее в больших количествах, необходимо было открыть способ выкачивания нефти из обширных подземных месторождений. Американский изобретатель Эдвин Лаурентин Дрейк (1819—1880) первым в 1859 г. начал бурить нефтяные скважины. Столетие спустя нефть стала основным источником органических соединений, источником тепла и энергии.
Еще более важным источником органических продуктов является каменный уголь, хотя в век двигателей внутреннего сгорания мы обычно забываем о нем. Русский химик Владимир Николаевич Ипатьев (1867—1952) на рубеже веков начал исследовать сложные углеводороды, содержащиеся в нефти и каменноугольном дегте, и, в частности, изучать их реакции, идущие при высоких температурах. Немецкий химик Фридрих Карл Рудольф Бергиус (1884—1949), используя данные Ипатьева, разработал в 1912 г. практические способы обработки каменного угля и нефти водородом с целью получения бензина.
Однако мировые запасы ископаемого топлива (каменный уголь плюс нефть) ограничены и невосполнимы. Все прогнозы говорят о том, что наступит день, когда запасы ископаемого топлива будут исчерпаны, и что этот день не за горами, особенно если учесть, что численность населения земли быстро увеличивается, а, следовательно, увеличивается и потребность в энергии [105].
Глава 11
Неорганическая химия
Новая металлургия
Хотя читателю может показаться, что XIX в., особенно его вторая половина, был веком органической химии, неорганическая химия в этот период также продолжала развиваться.
Одним из достижений в этой области явилось изобретение фотографии (см. гл. 9). Однако на развитии экономики или благосостоянии общества это изобретение, естественно, практически не сказалось. Еще одним достижением неорганической химии явилось усовершенствование способа зажигания огня. На протяжении тысячелетий человек добывал огонь трением. Со времени появления железа он научился высекать искры, ударяя огнивом (кресалом) о кремень. Оба способа были неудобны и утомительны, и со временем люди начали пытаться использовать для получения огня химические вещества, способные загораться при низких температурах в результате кратковременного трения. В 1827 г. английский изобретатель Джон Уолкер (приблизительно 1781—1859 гг.) предложил первые вполне пригодные для употребления фосфорные спички. За последующие полтора столетия спички значительно усовершенствовались, однако принцип их действия остался тем же.
Фотография и фосфорные спички — только два примера практических успехов неорганической химии. В полных и подробных трудах по истории химической науки эти и подобные им примеры заслуживают более чем простого упоминания, но в нашей краткой работе мы должны сосредоточить свое внимание на открытиях более крупных.
Самые большие успехи в области прикладной неорганической химии, безусловно, связаны с получением металлов и прежде всего стали, производство которой было и остается наиболее важной статьей экономики любой промышленно развитой страны. Если нефть для современного общества — источник сырья и топлива, то сталь — материальная основа практически всех отраслей промышленности.
Сталь, как мы отметили, начали получать и широко использовать еще три тысячелетия назад, но только в середине XIX в. был разработан способ, который обеспечивал массовое производство литой стали. Большая заслуга в этом принадлежит английскому металлургу Генри Бессемеру (1813—1898).
Бессемер работал над созданием артиллерийского снаряда, который вращался бы в полете и двигался по точно заданной траектории. Для этого Бессемеру необходимо было орудие с нарезным стволом, т. е. такое орудие, в стенках канала ствола которого имелись бы спиральные канавки, прорезанные от заднего конца ствола д<</div>






