- Введение
- Основы молекулярно-кинетической теории
- Твёрдое тело
- Жидкость
- Газ
- Плазма
- Сверхкритический флюид
- Конденсат Бозе — Эйнштейна
- Фермионный конденсат
- Вырожденная материя
- Другие состояния
- Виды агрегатных состояний веществ
- Влажность воздуха: испарение и конденсация
- График фазовых переходов
- Как влажность влияет на человека
- Реферат: агрегатное состояние вещества – – банк рефератов, сочинений, докладов, курсовых и дипломных работ
- Решение задач по фазовым переходам
- Сублимация и десублимация
- Три агрегатных состояния
Введение
Агрега́тное состоя́ние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.[1].
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состоянием причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Основы молекулярно-кинетической теории
Существует множество явлений природы, которые можно понять, лишь зная строение вещества. К таким явлениям относятся, например, процессы нагревания и охлаждения тел, превращения вещества из твёрдого состояния в жидкое и газообразное, образования тумана и др.
В основе молекулярно-кинетической теории строения вещества лежат три положения:
- Все вещества состоят из мельчайших частиц – молекул и атомов. Молекулы разделены промежутками.
- Молекулы находятся в беспрерывном хаотическом движении.
- Между молекулами существуют силы взаимодействия (притяжение и отталкивание).
Атом – наименьшая частица химического элемента, которая является носителем его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся по законам квантовой механики. Размеры атома ~ 10–10 м.
Молекула – наименьшая устойчивая частица вещества, обладающая всеми его химическими свойствами и состоящая из одинаковых (простое вещество) или разных (сложное вещество) атомов, объединённых химическими связями. При уменьшении расстояния между молекулами сила притяжения увеличивается медленнее, чем сила отталкивания.
Доказательством положения 1 МКТ служат факты, установленные в ходе наблюдений и экспериментов. К таким фактам относятся сжимаемость тел, растворимость веществ в воде и др. Так, если растворить немного краски в воде, то вода окрасится. Если каплю этой воды поместить в другой стакан с чистой водой, то эта вода также окрасится, только цвет её будет менее насыщенным.
Можно повторить эту операцию ещё несколько раз. В каждом случае раствор будет окрашен, только более слабо, чем в предыдущем. Это значит, что капля краски делится на частицы. Приведённые факты и описанный опыт позволяют сделать вывод о том, что тела не сплошные, они состоят из маленьких частиц.
О том, что тела не сплошные, а между частицами, из которых они состоят, существуют промежутки, свидетельствует то, что газ в цилиндре можно сжать поршнем, можно сжать воздух в воздушном шаре, ластик или кусок резины, тела сжимаются при охлаждении и расширяются при нагревании.
Из опытов, которые были рассмотрены выше, следует, что вещество можно разделить на отдельные частицы, сохраняющие его свойства. Однако существует определённый предел деления вещества, т.е. существует самая маленькая частица вещества, которая сохраняет его свойства.
Слова «химические свойства» означают следующее. Поваренная соль — это вещество, представляющее собой соединение натрия и хлора (NaCl). Это соединение имеет определённые химические свойства, в частности, оно может вступать в реакцию с каким-либо другим веществом.
Опыты, которые были описаны, говорят о том, что молекулы имеют маленькие размеры. Увидеть их невооруженным глазом невозможно. Диаметр крупных молекул примерно 10–8 см. Поскольку молекулы так малы, то в телах их содержится очень много. Так, в 1 см3 воздуха содержится 27*1018 молекул.
Масса молекул, так же как и её размеры, очень мала. Например, масса одной молекулы водорода равна 3,3 * 10–24 г или 3,3 * 10–27 кг. Масса молекул одного и того же вещества одинакова. В настоящее время масса и размеры молекул различных веществ определены достаточно точно.
Молекулы состоят из ещё более мелких частиц, которые называются атомами. Например, молекулу воды можно разделить на водород и кислород. Однако водород и кислород уже другие вещества, и они обладают свойствами, отличными от свойств воды. Разложить молекулу воды на такие вещества можно в процессе химической реакции.
Молекула воды состоит из двух атомов водорода и одного атома кислорода; молекула поваренной соли — из одного атома натрия и одного атома хлора. Молекула сахара более сложная: она состоит из б атомов углерода, 12 атомов водорода и 6 атомов кислорода, а молекула белков состоит из тысячи атомов.
Существуют вещества, молекулы которых содержат однородные атомы. Например, молекула водорода состоит из двух атомов водорода, молекула кислорода — из двух атомов кислорода.
В природе есть вещества, которые состоят не из молекул, а из атомов. Их называют простыми. Примерами таких веществ могут служить алюминий, железо, ртуть, олово и др.
Любое вещество, независимо от того, как оно получено, содержит одни и те же атомы. Например, молекула воды, полученная при таянии льда, или из сока ягод, или налитая из-под крана, содержит два атома водорода и один атом кислорода. Молекула кислорода, извлечённая из атмосферного воздуха или полученная в ходе какой-либо химической реакции, содержит два атома кислорода.
- Положение 2 МКТ. Молекулы находятся в непрерывном беспорядочном (хаотическом) движении. Поскольку молекулы малы, то непосредственно наблюдать и доказать их движение невозможно. Однако целый ряд экспериментальных фактов и наблюдаемых явлений является следствием движения молекул. К ним относятся прежде всего броуновское движение и диффузия.
- Положение 3 МКТ. Молекулы взаимодействуют между собой, между ними действуют силы и притяжения и отталкивания.
Наблюдения показывают, что тела не распадаются на отдельные молекулы. Твёрдые тела, например деревянную палку, металлический стержень, трудно растянуть или сломать. Их также трудно и сжать. Нелегко сжать и жидкость в сосуде. Газы сжать легче, но всё равно нужно приложить для этого некоторое усилие.
Если тела не распадаются на молекулы, то очевидно, что молекулы притягиваются друг к другу. Взаимное притяжение удерживает молекулы друг около друга.
Если взять два свинцовых цилиндра и прижать их друг к другу, а затем отпустить, то они разъединятся. Если поверхности цилиндров зачистить и вновь прижать их друг к другу, то цилиндры «слипнутся». Они не разъединятся даже в том случае, если к нижнему цилиндру подвесить груз массой несколько килограммов. Этот результат можно объяснить так: цилиндры удерживаются вместе, поскольку между молекулами действуют силы притяжения.
До того, как цилиндры зачистили, они разъединялись, поскольку поверхности цилиндров имели неровности, которые были устранены при зачистке. Поверхности стали гладкими, и это привело к уменьшению расстояний между молекулами, находящимися на поверхностях цилиндров, когда их прижали друг к другу.
Следовательно, силы притяжения между молекулами действуют на малых расстояниях. Эти расстояния равны примерно размерам молекулы. Именно поэтому нельзя разбив чашку и соединив осколки, получить целую чашку. Нельзя, разломив палку на две части и соединив их, получить целую палку.
Наряду с силами притяжения, между молекулами действуют силы отталкивания, которые препятствуют сближению молекул. Это объясняет то, что тела трудно сжать, сжатая пружина принимает первоначальную форму после прекращения действия на неё внешней силы. Это происходит потому, что при сжатии молекулы сближаются и силы отталкивания, действующие между ними, возрастают. Они и приводят пружину в первоначальное состояние.
При растяжении тела сила отталкивания уменьшается в большей степени, чем сила притяжения. При сжатии тела сила отталкивания увеличивается в большей степени, чем сила притяжения.
Твёрдое тело
Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Жидкость
Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако не способно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Газ
Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Плазма
Часто причисляемая к агрегатным состояниям вещества плазма отличается от газа большой степенью ионизации атомов. Большая часть барионного вещества (по массе ок. 99,9 %) во Вселенной находится в состоянии плазмы.[2]
Сверхкритический флюид
Возникает при одновременном повышении температуры и давления до критической точки, в которой плотность газа сравнивается с плотностью жидкости; при этом исчезает граница между жидкой и газообразной фазами. Сверхкритический флюид отличается исключительно высокой растворяющей способностью.
Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В результате этого часть атомов оказывается в состоянии со строго нулевой энергией (то есть в низшем из возможных квантовом состоянии). Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фишбаха.
Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов. (В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше. [3]
Вырожденная материя
- Ферми-газ 1-я стадия Электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия нейтронное состояние в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
- при сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно[4], деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно…
Другие состояния
При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния, безусловно, являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности.
Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.
Виды агрегатных состояний веществ
Нажав на кнопку “Скачать архив”, вы скачаете нужный вам файл совершенно бесплатно.
Перед скачиванием данного файла вспомните о тех хороших рефератах, контрольных, курсовых, дипломных работах, статьях и других документах, которые лежат невостребованными в вашем компьютере. Это ваш труд, он должен участвовать в развитии общества и приносить пользу людям. Найдите эти работы и отправьте в базу знаний.
Мы и все студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будем вам очень благодарны.
Чтобы скачать архив с документом, в поле, расположенное ниже, впишите пятизначное число и нажмите кнопку “Скачать архив”
Изменение свободной энергии, энтропии, плотности и других физических свойств вещества. Плазма – частично или полностью ионизированный газ. Свойства плазмы: степень ионизации, плотность, квазинейтральность. Получение и использование плазмы.
доклад [10,5 K], добавлен 28.11.2006
Особенности жидкого состояния вещества. Изменения свойств веществ при изменении агрегатного состояния. Современные представления о структуре металлической жидкости. Влияние микронеоднородности металлических расплавов на их физико-химические свойства.
курсовая работа [419,9 K], добавлен 17.12.2021
Содержание теории теплорода и описание атомного состава вещества. Раскрытие молекулярных свойств вещества. Природа хаотичного движения малых частиц взвешенных в жидкости или газе, уравнение броуновского движения. Свойства и объём молекул идеального газа.
презентация [127,2 K], добавлен 29.09.2021
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2021
Современные достижения и объективные ограничения в исследованиях экстремальных состояний вещества. Экстремальные состояния вещества. Состояние вещества в ходе ядерных, термоядерных и пикноядерных реакций. “Черные дыры”.
курсовая работа [116,0 K], добавлен 26.02.2003
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре -20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь. Но если мы тот же воздух поместим в помещение с температурой 20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит, что его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40-50%.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
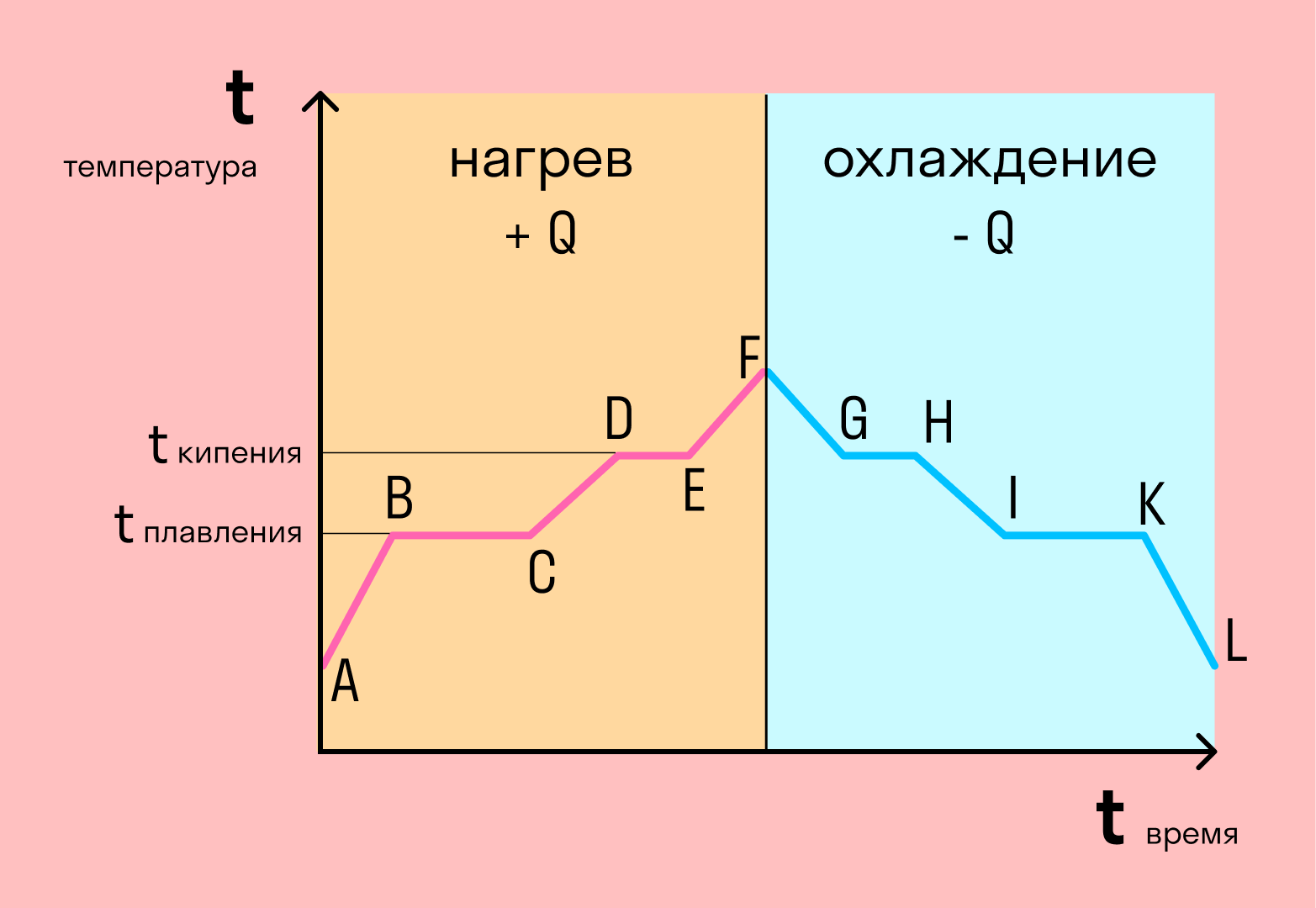
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
- DE — кипение (парообразование) воды
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание Q = cm(tконечная-tначальная) Охлаждение Q = cm(tначальная-tконечная)) Q — количество теплоты [Дж] c — удельная теплоемкость вещества [Дж/кг*˚C] m — масса [кг] tконечная — конечная температура [˚C] tначальная — начальная температура [˚C] |
Плавление Q = λm Кристаллизация Q = — λm Q — количество теплоты [Дж] λ — удельная теплота плавления вещества [Дж/кг] m — масса [кг] |
Парообразование Q = Lm Конденсация Q = — Lm Q — количество теплоты [Дж] L — удельная теплота парообразования вещества [Дж/кг] m — масса [кг] |
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.

Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Реферат: агрегатное состояние вещества – – банк рефератов, сочинений, докладов, курсовых и дипломных работ
Содержание
Введение
1.Агрегатное
состояние
вещества – газ
2.Агрегатное
состояние
вещества –
жидкость
3.Агрегатное
состояние
вещества –
твердое тело
4.Четвертое
состояние
вещества –
плазма
Заключение
Список
использованной
литературы
Введение
Как известно,
многие вещества
в природе могут
находиться
в трех состояниях:
твердом, жидком
и газообразном.
Сильнее всего
проявляется
взаимодействие
частиц вещества
в твердом состоянии.
Расстояние
между молекулами
примерно равно
их собственным
размерам. Это
приводит к
достаточно
сильному
взаимодействию,
что практически
лишает частицы
возможности
двигаться: они
колеблются
около некоторого
положения
равновесия.
Они сохраняют
форму и объем.
Свойства
жидкостей также
объясняются
их строением.
Частицы вещества
в жидкостях
взаимодействуют
менее интенсивно,
чем в твердых
телах, и поэтому
могут скачками
менять свое
местоположение
– жидкости не
сохраняют свою
форму – они
текучи.
Газ представляет
собой собрание
молекул, беспорядочно
движущихся
по всем направлениям
независимо
друг от друга.
Газы не имеют
собственной
формы, занимают
весь предоставляемый
им объем и легко
сжимаются.
Существует
еще одно состояние
вещества –
плазма.
Целью данной
работы является
– рассмотреть
существующие
агрегатные
состояния
вещества, выявить
все их достоинства
и недостатки.
Для этого
необходимо
выполнить и
рассмотреть
следующие
агрегатные
сотояния:
газ
жидкости
твердые
веществаплазма
Агрегатное
состояние
вещества – газ
Газы
(французское
gaz; название
предложено
голланским
учёным Я. Б.
Гельмонтом),
агрегатное
состояние
вещества, в
котором его
частицы не
связаны или
весьма слабо
связаны силами
взаимодействия
и движутся
свободно, заполняя
весь предоставленный
им объём. Вещество
в газообразном
состоянии
широко распространено
в природе. Газы
образуют атмосферу
Земли, в значительных
количествах
содержатся
в твёрдых земных
породах, растворены
в воде океанов,
морей и рек.
Солнце, звёзды,
облака межзвёздного
вещества состоят
из газов – нейтральных
или ионизованных
(плазмы). Встречающиеся
в природных
условиях газы
представляют
собой, как правило,
смеси химически
индивидуальных
газов.
Обладают
рядом характерных
свойств. Они
полностью
заполняют
сосуд, в котором
находятся, и
принимают его
форму. В отличие
от твёрдых тел
и жидкостей,
объём газов
существенно
зависит от
давления и
температуры.
Коэффициент
объёмного
расширения
газов в обычных
условиях (0-100°С)
на два порядка
выше, чем у
жидкостей, и
составляет
в среднем 0,003663
град-1.
Любое
вещество можно
перевести в
газообразное
состояние
надлежащим
подбором давления
и температуры.
Поэтому возможную
область существования
газообразного
состояния
графически
удобно изобразить
в переменных:
давление – р,
температура
– Т. При температурах
ниже критической
Тк эта область
ограничена
кривыми сублимации
(возгонки)/парообразования.
Это означает,
что при любом
давлении ниже
критического
рк существует
температура
Т, определяемая
кривой сублимации
или парообразования,
выше которой
вещество становится
газообразным.
Газ в этих состояниях
обычно называют
паром вещества.
При
температурах
ниже Тк можно
сконденсировать
газы – перевести
его в другое
агрегатное
состояние
(твёрдое или
жидкое). При
этом фазовое
превращение
газа в жидкость
или твёрдое
тело происходит
скачкообразно:
весьма малое
изменение
давления приводит
к конечному
изменению ряда
свойств вещества
(например, плотности,
энтальпии,
теплоёмкости
и др.). Процессы
конденсации
газов, особенно
сжижение газов,
имеют важное
техническое
значение.
В
связи с тем,
что область
газового состояния
очень обширна,
свойства газов
при изменении
температуры
и давления
могут меняться
в широких пределах.
Так, в нормальных
условиях (при
0°С и атмосферном
давлении) плотность
газов примерно
в 1000 раз меньше
плотности того
же вещества
в твёрдом или
жидком состоянии.
При комнатной
температуре,
но давлении,
в 1017 раз меньшем
атмосферного
(предел, достигнутый
современной
вакуумной
техникой),
плотность
газов составляет
около 10-20г/см3.
В космических
условиях плотность
газов может
быть ещё на 10
порядков меньше
(~10-30/см3).
С
другой стороны,
при высоких
давлениях
вещество, которое
при сверхкритических
температурах
можно считать
газом, обладает
огромной плотностью
(например, в
центре некоторых
звёзд ~109 г/см3).
В зависимости
от условий в
широких пределах
изменяются
и другие свойства
газов – теплопроводность,
вязкость и т.
д.
Молекулярно-кинетическая
теория газов.
Молекулярно-кинетическая
теория рассматривает
газы как совокупность
слабо взаимодействующих
частиц (молекул
или атомов),
находящихся
в непрерывном
хаотическом
(тепловом) движении.
На основе этих
простых представлений
кинетической
теории удаётся
объяснить
основные физические
свойства газов,
особенно полно
– свойства
разреженных
газов.
У
достаточно
разреженных
газов средние
расстояния
между молекулами
оказываются
значительно
больше радиуса
действия
межмолекулярных
сил. Так, например,
при нормальных
условиях в 1см3
газа находится
1019 молекул и
среднее расстояние
между ними
составляет
~ 10-6 см.
2. Агрегатное
состояние
вещества –
жидкость
Жидкость,
агрегатное
состояние
вещества,
промежуточное
между твёрдым
и газообразным
состояниями.
Ж., сохраняя
отдельные черты
как твёрдого
тела, так и газа,
обладает, однако,
рядом только
ей присущих
особенностей,
из которых
наиболее характерная
– текучесть.
Подобно твёрдому
телу, Ж. сохраняет
свой объём,
имеет свободную
поверхность,
обладает определённой
прочностью
на разрыв при
всестороннем
растяжении
и т. д. С другой
стороны, взятая
в достаточном
количестве
Ж. принимает
форму сосуда,
в котором находится.
Принципиальная
возможность
непрерывного
перехода Ж. в
газ также
свидетельствует
о близости
жидкого и
газообразного
состояний.
По химическому
составу различают
однокомпонентные,
или чистые. Ж.
и двух- или
многокомпонентные
жидкие смеси
(растворы). По
физической
природе Ж. делятся
на нормальные
(обычные), жидкие
кристаллы с
сильно выраженной
анизотропией
(зависимостью
свойств от
направления)
и квантовые
жидкости – жидкие
4He, 3He и их смеси
– со специфическими
квантовыми
свойствами
при очень низких
температурах.
Нормальные
чистые Ж. имеют
только одну
жидкую фазу
(т. е. существует
один единственный
вид каждой
нормальной
Ж.). Гелий 4He может
находиться
в двух жидких
фазах – нормальной
и сверхтекучей,
а жидкокристаллические
вещества – в
нормальной
и одной или
даже двух
анизотропных
фазах.
Общим для
всех нормальных
Ж., в том числе
и для смесей,
является их
макроскопическую
однородность
и изотропность
при отсутствии
внешних воздействий.
Эти свойства
сближают Ж. с
газами, но резко
отличают их
от анизотропных
кристаллических
твёрдых тел.
Аморфные твёрдые
тела (например,
стекла), с современной
точки зрения,
являются
переохлажденными
Ж. и отличаются
от обычных Ж.
только численными
значениями
кинетических
характеристик
(существенно
большей вязкостью
и др.). Область
существования
нормальной
жидкой фазы
ограничена
со стороны
низких температур
фазовым переходом
в твёрдое состояние
– кристаллизацией
или (в зависимости
от величины
приложенного
давления) фазовым
переходом в
сверхтекучее
состояние для
4He и в жидко-анизотропное
состояние для
жидких кристаллов.
При давлениях
ниже критического
давления ркнормальная
жидкая фаза
ограничена
со стороны
высоких температур
фазовым переходом
в газообразное
состояние –
испарением.
При давлениях
р > рк фазовый
переход отсутствует
и по своим физическим
свойствам Ж.
в этой области
неотличима
от плотного
газа. Наивысшая
температура
Tk,при которой
ещё возможен
фазовый переход
Ж. – газ, называется
критической.
Значения pk?и Tk определяют
критическую
точку чистой
Ж., в которой
свойства Ж. и
газа становятся
тождественными.
Наличие критической
точки для фазового
перехода Ж. –
газ позволяет
осуществить
непрерывный
переход из
жидкого состояния
в газообразное,
минуя область,
где газ и Ж.
сосуществуют.
Таким образом,
при нагревании
или уменьшении
плотности
свойства Ж.
(теплопроводность,
вязкость,
самодиффузия
и др.), как правило,
меняются в
сторону сближения
со свойствами
газов. Вблизи
же температуры
кристаллизации
большинство
свойств нормальных
Ж. (плотность,
сжимаемость,
теплоёмкость,
электропроводность
и т. д.) близки
к таким же свойствам
соответствующих
твёрдых тел.
В табл. приведены
значения теплоёмкости
при постоянном
давлении (Ср)
ряда веществ
в твёрдом и
жидком состояниях
при температуре
кристаллизации.
Малое различие
этих теплоёмкостей
показывает,
что тепловое
движение в Ж.
и твёрдых телах
вблизи температуры
кристаллизации
имеет примерно
одинаковый
характер.
Молекулярная
теория жидкости.
По своей природе
силы межмолекулярного
взаимодействия
в Ж. и кристаллах
одинаковы и
имеют примерно
одинаковые
величины. Наличие
в Ж. сильного
межмолекулярного
взаимодействия
обусловливает,
в частности,
существование
поверхностного
натяжения на
границе Ж. с
любой др. средой.
Благодаря
поверхностному
натяжению Ж.
стремится
принять такую
форму, при которой
её поверхность
(при данном
объёме) минимальна.
Небольшие
объёмы Ж. имеют
обычно характерную
форму капли.
В отсутствии
внешних сил,
когда действуют
только межмолекулярные
силы (например,
в условиях
невесомости),
Ж. приобретает
форму шара.
Влияние поверхностного
натяжения на
равновесие
и движение
свободной
поверхности
Ж., границ Ж. с
твёрдыми телами
или границ
между несмешивающимися
Ж. относится
к области капиллярных
явлений.
3. Агрегатное
состояние
вещества –
твердое тело
Твёрдое
тело, одно из
четырёх агрегатных
состояний
вещества,
отличающееся
от др. агрегатных
состояний
(жидкости, газов,
плазмы) стабильностью
формы и характером
теплового
движения атомов,
совершающих
малые колебания
около положений
равновесия.
Наряду с кристаллическим
состоянием
Т. т. существует
аморфное состояние,
в том числе
стеклообразное
состояние.
Кристаллы
характеризуются
дальним порядком
в расположении
атомов. В аморфных
телах дальний
порядок отсутствует
.
Т. т. – основной
материал,
используемый
человеком. От
кремнёвых
орудий неандертальца
до современных
машин и механизмов
– во всех технических
приспособлениях,
созданных
человеком,
используются
различные
свойства Т. т.
Если на ранних
ступенях развития
цивилизации
использовались
механические
свойства Т. т.,
которые непосредственно
ощутимы человеком
(твёрдость,
масса, пластичность,
упругость,
хрупкость и
т. п.), и Т. т. применялось
лишь как конструкционный
материал, то
в современном
обществе используется
огромный арсенал
физических
свойств Т. т.
(электрических,
магнитных,
тепловых и
др.), как правило,
не доступных
непосредственному
человеческому
восприятию
и обнаруживаемых
только при
лабораторных
исследованиях.
Механические
свойства Т. т.
(реакции на
внешние механические
воздействия
– сжатие, растяжение,
изгиб, удар и
т. д.) определяются
силами связи
между его
структурными
частицами.
Многообразие
этих сил приводит
к разнообразию
механических
свойств: одни
Т. т. пластичны,
другие хрупки.
Обычно металлы,
в которых силы
связи определяются
коллективным
действием
электронов
проводимости,
более пластичны,
чем диэлектрики;
например, деформация
Cu при комнатной
температуре
в момент разрыва
достигает
нескольких
десятков %, а
NaCI разрушается
почти без деформации
(хрупкость).
Механические
характеристики
изменяются
с температурой,
например с
повышением
температуры
пластичность
обычно увеличивается.
У большинства
Т. т. реакция
на внешнее
механическое
воздействие
зависит от его
темпа: хрупкое
при ударе Т. т.
может выдержать
значительно
большую статическую
нагрузку.
При небольших
статических
нагрузках у
всех Т. т. наблюдается
линейное соотношение
между напряжением
и деформацией
(Гука закон).
Такая деформация
называется
упругой. Упругая
деформация
обратима: при
снятии напряжения
она исчезает.
Для идеального
монокристалла
(без дефектов)
область обратимой
деформации
наблюдалась
бы вплоть до
разрушения,
причём предел
прочности
должен был бы
соответствовать
силам связи
между атомами.
При больших
нагрузках
реакция реального
Т. т. существенно
зависит от
дефектности
образца (от
наличия или
отсутствия
дислокаций,
от размеров
кристаллических
зёрен и т. п.) –
разрушение
начинается
в самых слабых
местах. Дислокация
– наиболее подвижный
дефект кристалла,
поэтому именно
дислокации
в большинстве
случаев определяют
его пластичность.
Появление
(рождение) и
перемещение
дислокации
– элементарные
акты пластичности.
Тепловые
свойства Т. т.
У большинства
Т. т. теплоёмкость
С при комнатных
температурах
приближённо
подчиняется
Дюлонга и Пти
закону: С = 3R кал/моль
(R – газовая
постоянная).
Закон Дюлонга
и Пти – следствие
того, что за
тепловые свойства
Т. т. при высоких
температурах
ответственны
колебательные
движения атомов,
подчиняющиеся
закону равнораспределения
(средняя энергия,
приходящаяся
на одну колебательную
степень свободы,
равна kT). Наблюдаемые
при высоких
температурах
отклонения
от закона Дюлонга
и Пти объясняются
повышением
роли ангармонизма
колебаний.
Понижение
температуры
приводит к
уменьшению
теплоёмкости;
благодаря
квантовому
“замораживанию”
средняя энергия
колебания Ek,
определяемая
выражением:
, меньше kT. При
самых низких
температурах
часть теплоёмкости,
обусловленная
колебаниями
решётки, С ~ T3.
Колебательная
часть теплоёмкости
Т. т. может быть
представлена
как теплоёмкость
газа фононов.
Теплопроводность
зависит от типа
Т. т. Металлы
обладают значительно
большей теплопроводностью,
чем диэлектрики,
что связано
с участием
электронов
проводимости
в переносе
тепла (см. ниже).
Теплопроводность
– структурно
чувствительное
свойство. Коэффициент
теплопроводности
зависит от
кристаллического
состояния
(моно- или поликристалл),
наличия или
отсутствия
дефектов и т.
п. Явление
теплопроводности
удобно описывать,
используя
концепцию
квазичастиц.
Все квазичастицы
(прежде всего
фононы) переносят
тепло, причём,
согласно кинетической
теории газов,
вклад каждого
из газов квазичастиц
в коэффициент
теплопроводности
можно записать
в виде: , где
g – численный
множитель, С
– теплоёмкость,
?- средняя тепловая
скорость, l –
длина свободного
пробега квазичастиц.
Величина l
определяется
рассеянием
квазичастиц,
которое в случае
фонон-фононных
столкновений
– следствие
ангармоничности
колебаний.
4. Четвертое
состояние
вещества –
плазма
Плазма
(от греч. plбsma
– вылепленное,
оформленное),
частично или
полностью
ионизованный
газ, в котором
плотности
положительных
и отрицательных
зарядов практически
одинаковы. При
достаточно
сильном нагревании
любое вещество
испаряется,
превращаясь
в газ. Если
увеличивать
температуру
и дальше, резко
усилится процесс
термической
ионизации, т.
е. молекулы
газа начнут
распадаться
на составляющие
их атомы, которые
затем превращаются
в ионы. Ионизация
газа, кроме
того, может
быть вызвана
его взаимодействием
с электромагнитным
излучением
(фотоионизация)
или бомбардировкой
газа заряженными
частицами.
Свободные
заряженные
частицы – особенно
электроны –
легко перемещаются
под действием
электрического
поля. Поэтому
в состоянии
равновесия
пространственные
заряды входящих
в состав П.
отрицательных
электронов
и положительных
ионов должны
компенсировать
друг друга так,
чтобы полное
поле внутри
П. было равно
нулю. Именно
отсюда вытекает
необходимость
практически
точного равенства
плотностей
электронов
и ионов в П.- её
“квазинейтральности”.
Нарушение
квазинейтральности
в объёме, занимаемом
П., ведёт к немедленному
появлению
сильных электрических
полей пространственных
зарядов, тут
же восстанавливающих
квазинейтральность.
Степенью ионизации
П. a называется
отношение числа
ионизованных
атомов к полному
их числу в единице
объёма П. В
зависимости
от величины
a говорят о слабо,
сильно и полностью
ионизованной
П.
Термин
“Плазма” в физике
был введён в
1923 американским
учёными И. Ленгмюром
и Л. Тонксом,
проводившими
зондовые измерения
(см. ниже) параметров
низкотемпературной
газоразрядной
П. Кинетика П.
рассматривалась
в работах Л. Д.
Ландау в 1936 и 1946
и А. А. Власова
в 1938. В 1942 Х. Альфвен
предложил
уравнения
магнитной
гидродинамики
для объяснения
ряда явлений
в космической
П. В 1950 И. Е. Тамм
и А. Д. Сахаров,
а также американский
физик Л. Спицер
предложили
идею магнитной
термоизоляции
П. для осуществления
УТС. В 50-70-е гг. 20 в.
изучение П.
стимулировалось
различными
практическими
применениями
П., развитием
астрофизики
и космофизики
(наблюдение
космической
П. и объяснение
процессов в
ней) и физики
верхней атмосферы
Земли – особенно
в связи с полётами
космических
летательных
аппаратов, а
также интенсификацией
исследований
по проблеме
УТС.
В резком
отличии свойств
П. от свойств
нейтральных
газов определяющую
роль играют
два фактора.
Во-первых,
взаимодействие
частиц П. между
собой характеризуется
кулоновскими
силами притяжения
и отталкивания,
убывающими
с расстоянием
гораздо медленнее
(т. е. значительно
более “дальнодействующими”),
чем силы взаимодействия
нейтральных
частиц. По этой
причине взаимодействие
частиц в П. является,
строго говоря,
не “парным”,
а “коллективным”
– одновременно
взаимодействует
друг с другом
большое число
частиц. Во-вторых,
электрические
и магнитные
поля очень
сильно действуют
на П. (в то время
как они весьма
слабо действуют
на нейтральные
газы), вызывая
появление в
П. объёмных
зарядов и токов
и обусловливая
целый ряд
специфических
свойств П. Эти
отличия позволяют
рассматривать
П. как особое,
четвёртое
состояние
вещества.
П. называется
идеальной, если
потенциальная
энергия взаимодействия
частиц мала
по сравнению
с их тепловой
энергией. Это
условие выполняется,
когда число
частиц в сфере
радиуса D велико:
ND = (4/3)
pD3n >> 1. В молнии
Т ~ 2 х 104 К, n~
2,5 Ч1019 (плотность
воздуха) и,
следовательно,
D ~ 10-7см, но ND
~1/10 Такую
П. называют
слабонеидеальной.
Заключение
Подведем
итоги проделанной
работы:
Газы
– агрегатное
состояние
вещества, в
котором его
частицы не
связаны или
весьма слабо
связаны силами
взаимодействия
и движутся
свободно, заполняя
весь предоставленный
им объём. Вещество
в газообразном
состоянии
широко распространено
в природе. Газы
образуют атмосферу
Земли, в значительных
количествах
содержатся
в твёрдых земных
породах, растворены
в воде океанов,
морей и рек.
Жидкость
– агрегатное
состояние
вещества,
промежуточное
между твёрдым
и газообразным
состояниями.
Ж., сохраняя
отдельные черты
как твёрдого
тела, так и газа,
обладает, однако,
рядом только
ей присущих
особенностей,
из которых
наиболее характерная
– текучесть.
Подобно твёрдому
телу, Ж. сохраняет
свой объём,
имеет свободную
поверхность,
обладает определённой
прочностью
на разрыв при
всестороннем
растяжении
и т. д.
Твёрдое
тело – одно из
четырёх агрегатных
состояний
вещества,
отличающееся
от др. агрегатных
состояний
стабильностью
формы и характером
теплового
движения атомов,
совершающих
малые колебания
около положений
равновесия.
Кристаллы
характеризуются
дальним порядком
в расположении
атомов. В аморфных
телах дальний
порядок отсутствует.
Плазма
– частично
или полностью
ионизованный
газ, в котором
плотности
положительных
и отрицательных
зарядов практически
одинаковы. При
достаточно
сильном нагревании
любое вещество
испаряется,
превращаясь
в газ. Если
увеличивать
температуру
и дальше, резко
усилится процесс
термической
ионизации, т.
е. молекулы
газа начнут
распадаться
на составляющие
их атомы, которые
затем превращаются
в ионы.
Список
использованной
литературы
Арцимович
Л. А., Элементарная
физика плазмы,
3 изд., М., 2002;Франк-Каменецкий
Д. А., Лекции по
физике состояний
вещества, М.,
2003 (переиздание);Френкель
Я. И., Собрание
избранных
трудов, т. 3, М.,
2001;Фишер И.3.,
Статистическая
теория жидкостей,
М., 2003;Физика простых
жидкостей.
Экспериментальные
исследования,
пер. с англ., М.,
2002 [в печати].
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
- Сначала нужно перевести массу в килограммы:
- Берем формулу количества теплоты для нагревания вещества:
- Подставляем числа:
100 г = 0,1 кг
Q = cm(tконечная-tначальная)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
- Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
- Берем формулу количества теплоты для плавления вещества:
- Подставляем числа:
2,5 т = 2500 кг
80 кДж/кг = 80000 Дж/кг
Q = λm
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
Примерчики из жизни🤓 Про белье. Попробуйте повесить белье сушиться на улицу в мороз. Поскольку вода замерзает из-за низких температур, белье должно вернуться домой в виде большого айсберга, но этого не происходит — оно возвращается абсолютно сухим. В данном процессе произошла возгонка молекул воды (сублимация). Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка. Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха. |
Три агрегатных состояния
Вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Свойства тел в разных агрегатных состояниях различны.
Так, твёрдое тело имеет определённую форму и определённый объём. Его трудно сжать или растянуть; если его сжать, а потом отпустить, то оно, как правило, восстанавливает свою форму и объём. Исключение составляют некоторые вещества, твёрдое состояние которых близко по своим свойствам к жидкостям (пластилин, воск, вар).
Жидкость принимает форму сосуда, в который она налита. Это говорит о том, что жидкость в условиях Земли не имеет своей формы. Только очень маленькие капли жидкости имеют свою форму — форму шара.
Объём жидкости изменить чрезвычайно трудно. Так, если набрать воду в насос, закрыть отверстие внизу и попытаться сжать воду, вряд ли это удастся. Это означает, что жидкость имеет собственный объём.
В отличие от жидкости объём газа изменить довольно легко. Это можно сделать, сжав руками мяч или воздушный шарик. Газ не имеет собственного объёма, он занимает полностью объём сосуда, в котором находится. То же можно сказать и о форме газа.
Таким образом, твёрдые тела имеют собственные форму и объём, жидкости имеют собственный объём, но не имеют собственной формы, газы не имеют ни собственного объёма, ни собственной формы. Твёрдые тела и жидкости трудно сжать, газы легко сжимаемы.
Объяснить эти свойства тел можно, используя знания о строении вещества.
Поскольку газы занимают весь предоставленный им объём, то очевидно, что силы притяжения между молекулами газа малы. А это значит, что молекулы находятся на сравнительно больших расстояниях друг от друга. В среднем они в десятки раз больше расстояний между молекулами жидкости. Это подтверждается тем, что газы легко сжимаемы.
Малые силы притяжения влияют и на характер движения молекул газа. Молекула газа движется прямолинейно до столкновения с другой молекулой, в результате чего меняет направление своего движения и движется прямолинейно до следующего столкновения.
Твёрдые тела трудно сжать. Это связано с тем, что молекулы находятся близко друг от друга и при небольшом изменении расстояния между ними резко возрастают силы отталкивания. Сравнительно большое притяжение между молекулами твёрдых тел приводит к тому, что они сохраняют форму и объём.
Атомы или молекулы большинства твёрдых тел расположены в определённом порядке и образуют кристаллическую решётку. На рисунке 63 изображена кристаллическая решётка поваренной соли. В узлах кристаллической решётки находятся атомы натрия (Na) и хлора (Сl). Частицы твёрдого тела (атомы или молекулы) совершают колебательное движение относительно узла кристаллической решётки.
В жидкостях молекулы расположены также довольно близко друг к другу. Поэтому их трудно сжать, и они имеют свой объём. Однако силы притяжения между молекулами жидкости не настолько велики, чтобы жидкость сохраняла свою форму.







