Введение: ПРОСТЕЙШИЕ————————————————————2
2 Амебиаз (амебная дизентерия E.histolytica)—————–7
2.1 Историческая справка————————————————————— 7
2.2. Морфология и жизненный цикл возбудителя———————————-8
2.3.Распространенность—————————————————————–10
2.4.Патогенез и иммунитет————————————————————-10
2.5.Клинические проявления ———————————————————.12
2.6.Дифференциальный диагноз —————————————————–17
2.7.Клиническая и лабораторная диагностика————————————-17
2.8.Дифференциальная диагностика E.histolytica от E.coli:———————19
2.9.Лечение——————————————————————————–21
2.10.Эпидемиология———————————————————– ——–23
2.11.Профилактика————————————————————- ——24
Заключение————————————————————————– —25
Библиографический список ————————————————– —–26
Введение
1. ПРОСТЕЙШИЕ
К типу простейших (Protozoa)
относится свыше 15000 видов животных, обитающих в морях, пресных водах, почве. Помимо свободноживущих форм, известно много паразитических, которые вызывают порой серьезные заболевания – протозоонозы.
Тело простейших состоит только из одной клетки. Форма тела простейших разнообразна. Оно может быть постоянным, иметь лучевую, двустороннюю симметрию (жгутиковые, инфузории) или вообще не иметь постоянной формы (амеба). Размеры тела простейших обычно малы – от 2-4 мк до 1,5 мм, хотя некоторые крупные особи достигают 5 мм в длину, а ископаемые раковинные корненожки имели в диаметре 3 см и более.
Тело простейших состоит из цитоплазмы и ядра. Цитоплазма ограничена наружной цитоплазмотической мембраной, в ней находятся органоиды — митохондрии, рибосомы, эндо-плазматическая сеть, аппарат Гольджи. У простейших одно или несколько ядер. Форма деления ядра – митоз.
Имеется также половой процесс. Он заключается в образовании зиготы. Органоиды движения простейших – это жгутики, реснички, ложноножки; или их нет совсем. Большинство простейших, как и все прочие представители животного царства, гетеротрофы. Однако среди них имеются и автотрофные.
Особенность простейших переносить неблагоприятные условия окружающей среды – состоит в способности инцистироваться
, т.е. образовывать цисту
. При образовании цисты органоиды движения исчезают, объем животного уменьшается, оно приобретает округлую форму, клетка покрывается плотной оболочкой. Животное переходит в состояние покоя и при наступлении благоприятных условий возвращается к активной жизни.
Инцистирование является приспособлением, служащим не только для защиты, но и для распространения паразитов. Некоторые простейшие (споровики) образуют овоцисту
и в процессе размножения – спороцисту.
Размножение простейших весьма разнообразно, от простого деления (бесполое размножение) до довольно сложного полового процесса – конъюгации и копуляции.
Среда обитания простейших разнообразна – это море, пресные воды, влажная почва.
Широкое распространение получил паразитизм.
Многие виды паразитических простейших вызывают тяжелые фор-мы заболеваний человека, домашних и промысловых животных, а также растений.
2.1 Историческая справка
О
писание клиники амебной дизентерии встречается уже в трудах великого древнегреческого целителя Гиппократа; в средние века Авиценна в своем “Каноне” приводит клиническую характеристику заболевания, сопровождающегося кровавым поносом и язвенным поражением толстого кишечника – заболевания, неизменно сопутствующего всем войнам, известным в истории человечества.
Вероятнее всего, этим можно объяснить тот факт, что честь открытия возбудителя амебиаза принадлежит военному врачу, приват-доценту Военно-медицинской академии в Петербурге, русскому ученому Федору Александровичу Лешу. В 1873 г. он обнаружил амебу (работа опубликована в 1875 г.) у страдающего бактериальной дизентерией и амебиазом больного Маркова, крестьянина из Архангельской области, работающего грузчиком С.
-Петербургского порта. Ф.А.Леш впервые дал морфологическое описание вегетативной стадии амебы с фагоцитированными эритроцитами, подробно описал патологоанатомические изменения кишечника при амебиазе. Для доказательства патогенной роли амебы он впервые произвел экспериментальное заражение собак, описал развитие у них клиники острого амебиаза и обнаружил в испражнениях паразитов, по строению и поведению аналогичных амебам, найденных им у больного.
Кроме того Леш впервые предложил важнейшие методы лабораторной диагностики амебной дизентерии, актуальные и в настоящее время. Найденного им возбудителя Ф.А.Леш назвал кишечной амебой – Amoeba coli. В 1903 г. Ф.Шаудин присвоил дизентерийной амебе название Entamoeba histolytica, с этого времени Entamoeba coli называют непатогенную амебу, обитающую в кишечнике человека.
Долгое время существовала так называемая “унитарная” теория происхождения вида E. histolytica. Ее создатели утверждали, что все встречающиеся у человека амебы с 4-х ядерными цистами относятся к виду E.histolytica и всегда патогенны для своего хозяина.
В дальнейшем накапливалось все больше данных об отсутствии во многих случаях паразитирования E.histolytica патологических изменений в кишечнике. Попытка объяснить это явление была сделана в 1925 г. E.Brumpt, выдвинувшим так называемую “дуалистическую” теорию По мнению французского паразитолога вид E.histolytica является сборным и включает в себя два самостоятельных, но морфологически тождественных вида, один из которых – патогенный – он назвал E.dysenteria и другой – непатогенный – E.dispar.
Первый широко распространен в странах с тропическим климатом, второй – в средних широтах и на севере. В настоящее время на основании изучения паразитарных изоэнзимов, полученных в результате электрофореза, выделяют морфологически сходные, но различающиеся по патогенности виды амеб:
2.2 Морфология и жизненный цикл возбудителя
В
озбудитель амебиаза- E.histolytica относится к подцарству Protozoa, типу Sarcomastigophora, классу Lobosea, отряду Amoebida, семейству Entamoebidae, роду Entamoeba.
В жизненном цикле E.histolytica различают две стадии: вегетативную стадию или трофозоит
– активную, подвижную, размножающуюся и стадию цисты
– неподвижную, не размножающуюся, неспособную к захвату пищевых частиц. Заражение амебами происходит при заглатывании цист, чаще всего с контаминированной водой или пищей.
Цисты устойчивы к пребыванию во внешней среде, могут находиться вне организма неделями и даже месяцами, являясь таким образом пропагативной стадией. Эксцистирование происходит в самом начале толстого кишечника, т.е. в слепой кишке, в результате деления ядра и цитоплазмы из одной проглоченной 4-х ядерной цисты образуется 8 трофозоитов.
Трофозоиты обитают в проксимальных отделах толстого кишечника, питаясь бактериями и клеточным детритом, размножаясь путем двойного деления. При некоторых неблагоприятных условиях (изменениях пищевого режима, в частности употреблении острой раздражающей пищи, резких температурных колебаниях, изменении состояния микрофлоры кишечника, нарушениях слизистого барьера кишечника, изменении секреторной деятельности пищеварительных органов, авитаминозах, инфекционных и неинфекционных заболеваниях кишечника и других, еще недостаточно изученных факторах) трофозоиты могут внедряться в стенку толстого кишечника, вызывая язвенное поражение и приобретают при этом способность заглатывать эритроциты, превращаясь в гематофаги. Гематофаги выделяются во время острого колита, при нормализации характера стула они инцистируются.
Вегетативная стадия – гематофаг (тканевая форма)
– обнаруживается в свежевыделенных фекалиях больного в острой фазе амебной дизентерии. Гематофаги находят среди одиночно разбросанных эритроцитов, лейкоцитов, а также макрофагов, грибов в виде больших, сильно преломляющих свет образований, имеющих размеры 18-45 мкм, которые при движении могут вытягиваться в длину до 60 мкм и приобретать причудливые очертания.
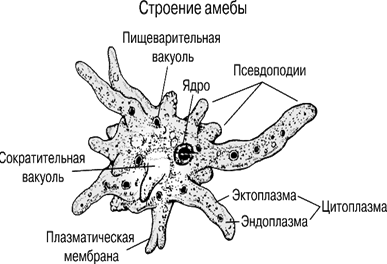
Цитоплазма разделена на внутреннюю зернистую, темную и мутную часть – эндоплазму и наружную, светлую, прозрачную, неравномерной толщины – эктоплазму. В эндоплазме, в пищеварительных вакуолях, находят фагоцитированные эритроциты, часто в таких больших количествах, что придают ей красно-бурый цвет.
При температуре 20° С и выше амебы обладают прогрессивно-поступательным движением, псевдоподии образуются в результате выпячивания эктоплазмы, их возникновение происходит быстро, “взрывом” или толчком. Возникшая псевдоподия увеличивается, в нее переливается эндоплазма и амеба перемещается в направлении образовавшейся псевдоподии.
Ядро микроорганизма находится в эндоплазме. У живых амеб в свежих, неокрашенных препаратах его не видно. При окраске ядро выявляется в виде колечка, образованного мелкими глыбками хроматина, лежащими на внутренней оболочке ядра.
Просветная форма
– имеет размер от 7 до 24 мкм ( в среднем – 13 мкм), форма ее круглая или овальная, деление на два слоя еле заметно, обычно заметно лишь при образовании псевдоподий, формирующихся медленнее, чем у тканевых форм. В эндоплазме имеется большое число вакуолей, содержащих бактерии и детрит, но никогда не содержащих фагоцитированные эритроциты, даже если они есть в кишечном содержимом.
Ядро без окраски не видно. Обычно эти формы обнаруживают в небольшом количестве у здоровых носителей при приеме ими слабительных или при развитии диареи, обусловленной иными причинами, так как в оформленных фекалиях просветные формы успевают инцистироваться.
Обнаружение просветных форм у пациентов в значительном количестве может свидетельствовать либо о начальной стадии амебной дизентерии, либо о перенесенном в недавнем прошлом обострении хронического амебиаза. В этих случаях, как и при острой амебной дизентерии, наряду с амебами, могут обнаруживаться кристаллы Шарко-Лейдена, имеющие вытянутую ромбовидную форму и разнообразную величину.
 Цисты
Цисты
обнаруживают в оформленных испражнениях уздоровых лиц или у лиц, страдающих рецидивирующим колитом и находящихся в стадии реконвалесценции. Форма цист в большинстве круглая, сферическая, иногда овальная. Диаметр цист – от 8 до 15 мкм, наиболее часто – 11-12 мкм. Мелкозернистая цитоплазма цист окружена хорошо выраженной двухслойной оболочкой, состоящей из хитина и предохраняющей их от некоторых воздействий внешней среды. В цитоплазме цист не находят переваренных частиц, но выявляют гликоген, занимающий ее центральную часть, хроматоидные тела (рибосомы) в виде блестящих палочек с закругленными концами или хорошо преломляющих свет брусочков с закругленными концами. Число их в отдельных цистах колеблется от одного до нескольких штук. Процент цист с хроматоидными телами зависит от степени зрелости цист и времени, прошедшего с момента их выделения из организма. Наиболее часто хроматоидные тела обнаруживаются в свежевыделенных одно- и двуядерных цистах. В зависимости от зрелости в цистах имеется разное число ядер – от 1 до 4-х. Ядра выявляются в виде колечка, образованного мелкими глыбками хроматина, лежащими на внутренней оболочке ядра. В центре ядра находится центральная кариосома в виде яркой блестящей точки.
2.3Распространенность
А
мебиаз – убиквитарная инфекция, в результате многих наблюдений было установлено, что около 10% мировой популяции инфицировано амебами. Ежегодная заболеваемость кишечным амебиазом составляет около 50 млн. случаев , летальность достигает 100000 случаев, т.е.
0,2% от выявленных случаев. Внекишечный амебиаз составляет лишь около 10% от всех случаев выявленного амебиаза. До 50% всех случаев этой инфекции приходится на развивающиеся страны. Наиболее распространена инфекция в Индии, в Южной Африке, в Западной Африке (Нигерия, Гана, Бенин, Берег Слоновой Кости )
, в Корее и Китае, в Южной и Центральной Америке (в Мексике за последние 9-10 лет заболеваемость резко возросла, около 9% населения инфицировано E.histolytica). Широкому распространению там амебиаза способствуют низкий уровень санитарных условий, невысокий социально-экономический статус, скученность жителей, некоторые особенности культурных традиций.
2.4.Патогенез и иммунитет
Н
азвание E.histolytica напрямую связано с литическим действием дизентерийной амебы на ткани. Ее прикрепление (адгезия) к слизистой кишечника происходит за счет паразитарного галактоз-ингибирующего-адгезивного лектина – пептида, который образует поры в слизистой и, таким образом, воздействует на защитную слизь кишечника,.
Паразитарный галактоз-ингибирующий-адгезивный лектин содержит поверхностный белок, состоящий из тяжелой (170 КД) и легкой (35 КД) субъединиц. Существует резистентность дизентерийной амебы к комплементу за счет того, что антигенные детерминанты субъединицы 170 КД сходны с таковыми у C8 и C9 системы комплемента.
На субъединице 170 КД существует не менее 5 эпитопов, некоторые из них при исследовании с помощью моноклональных антител обнаруживаются только у E.histolytica и не обнаруживаются у E.dispar, что свидетельствует о возможности дифференцировать патогенные и непатогенные виды между собой.
Помимо галактоз-ингибирующего-адгезивного лектина у E.histolytica найдено множество гемолизинов, переваривающих эритроциты и протеаз, разрушающих ткань кишечной стенки. У некоторых штаммов E.histolytica обнаружили гиалуронидазу, способствующую проникновению амеб в ткани.
Некоторые штаммы продуцируют энтеротоксины, однако их образование прямо не коррелирует с вирулентностью E.histolytica. Трофозоиты дизентерийной амебы обладают способностью осуществлять контактный лизис нейтрофилов, при разрушении которых выделяются монооксиданты, усиливающие начавшееся расплавление тканей хозяина.
При проникновении E.histolytica в подслизистый слой происходит интенсивное размножение паразитов, образуется первичный очаг в виде микроабсцесса, который вскрывается в полость кишки. Таким образом, сначала возникает язва небольших размеров. Размножающиеся амебы распространяются по периферии язвы и проникают вглубь, достигая мышечной стенки.
Небольшие язвы, расположенные вблизи друг от друга, могут сливаться, в результате образуются обширные поражения, имеющие в диаметре несколько сантиметров. На слизистой кишечника при остром амебиазе могут обнаруживаться язвы разной величины и формы: от очень маленьких, еле заметных до обширных фляжкоподобных с неровными подрытыми краями.
Дно язв покрыто некротическими массами. При неосложненном течении амебиаза слизистая оболочка между язвами сохраняет обычный вид. Наиболее часто язвенный процесс захватывает слепую кишку и прилегающую к ней восходящую часть толстой кишки. На втором месте по частоте локализации находятся сигмовидная и прямая кишка.
Характерным для амебного процесса является отсутствие синхронности в степени развития язв. На слизистой кишечника могут быть обнаружены одновременно мелкие эрозии, небольшие язвы, обширные поражения – до нескольких сантиметров в диаметре (“цветущие язвы”), заживающие язвы и рубцы после заживших язв.
При эрозии сосудов слизистой толстого кишечника трофозоиты E.histolytica попадают в портальную венозную систему, вызывая генерализацию инфекции с наиболее частым поражением печени (правой доли) и легких, реже других органов, где могут развиваться амебные абсцессы
Рис 2 Электронные фотографии клетки и цисты E.histolytica
Инфицирование организма E.histolytica сопровождается выработкой специфических Ат. Сыворотки от больных амебиазом и инфицированных E.histolytica лиц, имеющих высокие титры специфических Ат, тормозят адгезию амеб к клеткам и лизируют трофозоиты in vitro, за счет активации системы комплемента по классическому и альтернативному пути.
Секреторный противоамебный IgA обнаруживают при инвазивном амебиазе и в слюне, и в грудном молоке пациентов. Несмотря на раннее появление специфических Ат (при амебном абсцессе печени высокие титры Ат обнаруживаются уже на 17 день болезни) и длительное (до 10 лет) персистирование их в организме, патологический процесс, сопровождающий развитие амебного абсцесса печени, неуклонно прогрессирует.
Возможно, это объясняется тем, что имеющийся у трофозоитов амеб протеазный ингибитор – паразитарная цистеинпротеаза, быстро снижает количество сывороточных и секреторных Ig. Тем не менее значение специфических противоамебных антител нельзя умалять полностью: в опытах на животных было показано, что иммунизация специфическими Ат, содержащимися в сыворотке больных людей с амебным абсцессом печени, существенно ограничивала развитие амебного абсцесса печени у экспериментальных животных. Последний факт вселяет надежду на возможное получение вакцины против E.histolytica.
В ограничении распространенности патологического процесса при инвазивном амебиазе немаловажная роль принадлежит клеточным механизмам иммунной защиты. Амебоцидная активность макрофагов стимулируется (-интерфероном; фактор некроза опухолей (ФНО) усиливает амебоцидную активность нейтрофилов.
В опытах in vitro было обнаружено цитотоксическое действие CD8 лимфоцитов на трофозоиты E.histolytica при их совместной инкубации. Однако, как было установлено, при развитии острого инвазивного амебиаза активность Т-клеточного звена иммунной защиты снижается за счет выработки специфического сывороточного фактора, индуцированного паразитом.
Все же клеточный иммунитет имеет определенное значение в сдерживании амебной инфекции, о чем косвенно может свидетельствовать тяжелое течение амебной инфекции на фоне лечения кортикостероидами, приводящее к депрессии клеточного иммунитета. В пользу этого же положения могут служить случаи молниеносного течения амебиаза у недоношеннных детей и беременных женщин, страдающих в первую очередь от клеточного иммунодефицита.
В целом, как отмечает большинство исследователей, приобретенный в результате болезни иммунитет при амебиазе является нестойким и нестерильным, не предотвращая пациентов ни от рецидивов, ни от реинфекции.
2.5. Клинические проявления
О
бщепринятой классификации амебиаза до настоящего времени не имеется. Большинство предложенных не охватывает всего многообразия клинических форм или отличается громоздкостью. Наиболее удовлетворяющей всех схемой является деление амебиаза на кишечный
и внекишечный
амебиаз.
Кишечный
амебиаз в свою очередь подразделяется на следующие формы:
1. асимптомная инфекция; 2. амебная дизентерия; 3. молниеносный колит с перфорацией кишечника; 4. токсический мегаколон; 5. хронический амебный колит; 6. амебома; 7. перианальное иВнекишечный
амебиаз подразделяется на:
1.амебный абсцесс печени; 2. амебный абсцесс печени в сочетании с перитонитом; 3. амебный абсцесс печени, осложненный эмпиемой плевры; 4.амебный абсцесс печени, осложненный перикардитом; 5. амебный абсцесс легкого; 6. амебный абсцесс мозга; 7. мочеполовой амебиаз.
В странах, где амебиаз представляет собой важную проблему здравоохранения (страны с эндемичным распространением инфекции) большинство (приблизительно 90%) населения, зараженного E.histolytica, являются носителями, т.е. не имеют практически никаких признаков кишечной инфекции, тогда как остальные 10% страдают от инвазивного кишечного амебиаза.
Продолжительность инкубационного периода при остром кишечном амебиазе от нескольких дней до нескольких месяцев. Действительную продолжительность инкубационного периода установить в естественных условиях трудно, а зачастую невозможно. Продромальный период выражен неотчетливо.
За несколько дней до заболевания больные отмечают увеличивающееся недомогание, снижение аппетита, боли в животе разлитого характера. Болезнь начинается постепенно. Появляется учащенный стул, обычно не больше 3-5 раз в сутки, редко до 10-15 раз в сутки.
Фекалии сначала носят каловый характер, полуоформленные или жидкие, потом к ним примешивается слизь, количество которой день ото дня увеличивается. Затем появляются прожилки крови, которые пропитывают слизь, придавая ей характерный при амебной дизентерии вид “малинового желе”.
При развитии язвенного процесса больные жалуются на тенезмы, носящие порой мучительный характер; при пальпации живота отмечается вздутие и спастические сокращения слепой и толстой кишки, болезненность по ходу толстого кишечника. Для острой амебной дизентерии не характерна высокая лихорадка, температура, как правило, нормальная или повышается до субфебрильных цифр.
1 случай
Больной К., 55 лет поступил в ГКБ им. С. П .Боткина 25.01.1996 г. с жалобами на боли в левой половине живота спастического характера, полуоформленный стул 1-2 раза в сутки, с примесью слизи и прожилками крови, слабость, недомогание в течение 3-х мес.
Эпидемиологический анамнез
: в сентябре-октябре 1995 г. пациент находился в служебной командировке в Индии. Употребление сырой воды отрицает, купание, контакт с землей отрицает. Отметил, что пищу готовили местные повара, привычный режим питания был изменен, блюда содержали много острых приправ и пряностей.
Из анамнеза заболевания удалось выяснить, что первые признаки недомогания появились еще в Индии :возникли боли в животе, один день держалась субфебрильная температура, далее появился жидкий стул со слизью. Расценив свое состояние, как возможное отравление, больной никуда не обращался, лечился самостоятельно интестопаном и энтеросептолом.
В течение двух недель после возвращения он лечился дома, однако самочувствие не улучшалось, отметил появление в стуле прожилок крови, что заставило его обратиться за помощью в поликлинику по месту жительства. Среди перенесенных заболеваний у пациента обратили внимание на хронический геморрой внутренних узлов, в связи с чем он был направлен на консультацию к проктологу.
Проктолог предположил у больного обострение геморроя и назначил проведение срочной ректороманоскопии. При ректороманоскопии были обнаружены гиперемия, эрозии слизистой прямой и начала сигмовидной кишки, слизистая легко кровоточила, были найдены несколько глубоких, с подрытыми краями язв, неправильной формы, покрытых зеленоватым детритом.
В связи с выявленным язвенным колитом больному была назначена колоноскопия. Через две недели после первого обращения в поликлинику были получены результаты биопсии слизистой прямой кишки, произведенной в ходе эндоскопического исследования. В биоптатах прямой кишки были обнаружены тканевые формы E.histolytica, содержащие фагоцитированные эритроциты.
Таким образом, стертость клинических проявлений, имеющееся в анамнезе заболевание кишечника (хронический геморрой) вызвали затруднение в постановке диагноза амебной дизентерии, даже при нал типичного эпиданамнеза – пребывание в эндемичной по амебиазу стране (Индии).
Амебы, внедряясь в стенку толстой кишки и образуя в ней глубокие язвы, облегчают проникновение в кровь токсинов шигелл и других бактерий, населяющих кишечник, что зачастую приводит к развитию микст-инфекции, вызывающей определенные затруднения у клиницистов.
В свою очередь бактериальная дизентерия, вызывая нарушение слизистой кишечника, способствует возможности проникновения в кишечную стенку амеб. В таких случаях острая амебная дизентерия нередко протекает атипично. Приводим пример сочетанного течения бактериальной дизентерии с амебиазом кишечника.
2 случай
Больной К.,19 лет, коренной житель г. Термеза, заболел во время вступительных экзаменов в Ленинграде. Заболел остро, озноб, слабость, повышение температуры тела до 37,8(С. Через несколько часов присоединились приступообразные боли в нижней части живота и участился стул до 6 раз за сутки.
Испражнения вначале были кашицеобразные, затем жидкие, скудные. На следующий день слабость усилилась, стул участился до 10 раз в сутки – появились в испражнениях слизь и прожилки крови. С диагнозом “острая дизентерия” поступил в стационар. При поступлении : сильная головная боль, сухость во рту, частые императивные позывы к дефекации, периодические схваткообразные сильные боли в левых отделах живота, исчезающие после дефекации.
Температура 38,9(С, АД 100/60 мм.рт.ст. Язык сухой, с сероватым налетом. Живот вздут, при глубокой пальпации болезненность и спазм сигмовидной кишки. Фекалии скудные, жидкие, с примесью слизи. Назначены фуразолидон, поливитамины, но-шпа при болях. Через 3 дня самочувствие больного несколько улучшилось, температура снизилась до субфебрильной, но оставались позывы к дефекации, боли в нижней половине живота, стала отмечаться болезненность на всем протяжении толстого кишечника.
Из фекалий высеяна культура шигелл Флекснера 2a. В последующие дни, несмотря на проводимую терапию состояние и самочувствие больного не улучшались, с 5 дня болезни отмечено увеличение размеров печени и болезненность ее края при пальпации. Затяжное течение болезни и развитие явлений гепатита расценено как следствие недостаточной эффективности этиотропного лечения дизентерии.
В связи с этим фуразолидон был заменен на канамицин, проводились внутривенные вливания альбумина, что, однако, не привело к улучшению самочувствия больного. В фекалиях замечено появление комочков слизи, окрашенных в малиновый цвет. На 10-й день болезни во время ректороманоскопии у пациента выявлены диффузная гиперемия, отек и повышенная ранимость слизистой прямой и сигмовидной кишки, на глубине 15 см и выше – множественные язвы 3-7 мм в диаметре, с неровными подрытыми краями.
В биоптате обнаружены гематофаги E.histolytica. Больному был отменен канамицин и назначен метронидазол. На следующий день температура тела нормализовалась, через сутки уменьшилась частота позывов к дефекации, из фекалий исчезли слизь и примесь крови.
На 5-й день лечения нормализовались размеры печени. На 7-е сутки исчезла болезненность по ходу толстого кишечника. При контрольных исследованиях фекалий шигелл и амеб не выявлено. Больной выписан из стационара на 23-й день от начала заболевания в удовлетворительном состоянии.
Окончательный диагноз: острая дизентерия Флекснера 2a в сочетании с кишечным амебиазом и амебным гепатитом, среднетяжелое течение. Таким образом, недоучет эпидемиологического анамнеза (больной житель эндемичного по амебиазу региона) и запоздалое эндоскопическое исследование привели к тому, что правильный диагноз микст-инфекции был установлен только на 10-й день болезни.
В большинстве случаев острый кишечный амебиаз даже без специфического лечения через разные промежутки времени (от одной недели до нескольких недель) сменяется периодом временного улучшения. Понос прекращается, исчезают болезненные симптомы, наступает временное выздоровление.
Период реконвалесценции может продолжаться несколько недель, но потом вновь наступает обострение. Такая смена обострений и улучшений может продолжаться годами – болезнь приобретает характер хронического, длительно рецидивирующего колита. К сожалению, зачастую хронический амебный колит трудно отличить клинически от идиопатической болезни кишечника (неспецифического язвенного колита), что необходимо учитывать до начала специфической терапии НЯК кортикостероидами. Приводим пример осложнения такой терапии.
Результатом прямого распространения кишечного амебиаза являются поражения кожи в виде перианальных изъязвлений, которые зачастую легко путают с чешуйчатоклеточной карциномой. При биопсии перианальных язв в таких случаях обнаруживают трофозоиты E.histolytica и медикаментозная терапия весьма успешна.
Наиболее распространенная внекишечная форма инвазивного амебиаза – амебный абсцесс печени. Он наблюдается в 10 раз чаще у взрослых, чем у детей (чаще у лиц среднего и пожилого возраста), при более высокой частоте среди мужчин. Амебный абсцесс печени может развиться в течение острой кишечной инфекции, сразу после перенесенного амебного колита или спустя несколько месяцев/лет после перенесенного амебиаза кишечника.
Менее 30% больных с амебным абсцессом печени одновременно страдают амебной дизентерией. У небольшой части больных с абсцессом печени в анамнезе отсутствует указание на расстройства кишечника; по-видимому, у таких лиц кишечный амебиаз протекал в стертой форме.
Ряд авторов полагает, что для развития абсцесса печени имеются предрасполагающие моменты. Малярийные поражения печени могут благоприятствовать возникновению амебного поражения печени (см. 3случай, описанный выше).Чрезмерное употребление алкоголя также может явиться обстоятельством, способствующим развитию абсцесса в печени.
Наиболее часто амебный абсцесс печени начинается остро
– внезапно повышается температура тела, лихорадка носит постоянный характер, с небольшой разницей между утренней и вечерней температурой,при присоединении патогенной флоры, колебания могут быть значительны.
Высокая температура обычно сопровождается ознобом и обильным потоотделением в ночное время. Появляются постоянные боли давящего характера и чувство тяжести в правом подреберье, при движении боли усиливаются, могут иррадиировать в плечо; реже боли возникают в эпигастрии или в грудной клетке.
Менее чем у половины больных отмечается увеличенная и болезненная при пальпации печень (из-за малых размеров абсцесса этот признак может быть слабо выражен). Нечасто выявляется желтуха. Продолжительность симптомов при остром течении болезни обычно не более 10 дней.
В таких случаях быстро развиваются серьезные осложнения амебного абсцесса печени (прорыв в брюшную полость с развитием перитонита или в сердечную сумку с развитием перикардита, последнее осложнение характерно при локализации абсцесса в левой доле печени). Смертность больных при таком течении болезни очень высокая.
При подостром
течении амебного абсцесса печени симптомы болезни наблюдаются более 2-х недель. Больные имеют бледный, истощенный, изможденный вид, нарастает потеря веса (за счет резкого снижения аппетита). Лихорадка менее характерна. Они часто ходят очень осторожно, согнувшись в больную сторону.
В постели обычно сохраняют вынужденное положение, с приведенными к животу ногами. При осмотре у части больных обращают внимание на выбухание нижних отделов грудной клетки и верхней части живота справа, поколачивание в области абсцесса весьма болезненно.
При пальпации определяется увеличение правой доли печени (наиболее частая локализация амебных абсцессов печени), при длительном течении отмечается гипертрофия левой доли печени. К сожалению, и при остром и при подостром течении амебиаза печени настороженность клиницистов в отношении амебной этиологии абсцесса очень низкая, зачастую дифференциальный диагноз проводится с различными заболеваниями. нередко системного характера.
Вследствие того, что амебные абсцессы могут развиваться через несколько месяцев или даже лет после ликвидации процесса в кишечнике, при паразитологическом исследовании испражнений амебы не всегда обнаруживаются. Приведем несколько случаев течения амебных абсцессов печени, вызвавших у лечащих врачей определенные трудности в постановке правильного диагноза.
Таким образом, у больных с амебной дизентерией возможно развитие мочеполового амебиаза за счет прямого попадания возбудителей через изъязвленную поверхность слизистой прямой кишки в гениталии. Как отмечают авторы последнего сообщения, у женщин с нарушением целостности слизистой влагалища риск развития мочеполового амебиаза повышается.
2.6Дифференциальный диагноз
Д
ифференциальный диагноз острой амебной дизентерии необходимо проводить с шигеллезом, сальмонеллезом, кампилобактерозом, иерсиниозом, инфекционной небактериальной дизентерией. Хронический амебный колит дифференцируют с хроническим неспецифическим язвенным колитом.
Амебому дифференцируют с карциномой кишечника, лимфомой ЖКТ, туберкулезом, регионарным энтеритом и иерсиниозом. Больным с амебным абсцессом печени проводят обследование для исключения обструкции желчевыводящих путей, пиогенного абсцесса, нагноившейся эхинококковой кисты и гепатомы.
2.7Клиническая и лабораторная диагностика
В
подавляющем большинстве случаев инвазивного амебиаза с локализацией поражений в толстой кишке наиболее надежными диагностическими процедурами представляются ректороманоскопия с немедленным микроскопическим исследованием ректальных мазков (эффективно для постановки диагноза в случаях, когда поражения слизистой находятся в нижних отделах толстого кишечника – прямая и сигмовидная кишка) и/или свежих проб фекалий на наличие подвижных трофозоитов E.histolytica гематофагов. Паразитологический диагноз должен выполняться лаборантами, хорошо квалифицированными в этой области.
Основными методами являются исследование нативного неокрашенного мазка и свежего мазка, окрашенного йодом. Промежуток времени от момента выделения фекалий до исследования не должен превышать 15-20 мин. Под термином “теплые фекалии” следует понимать фекалии, не остывшие после выделения их из организма, но не подогретые искусственно.
Если препараты фекалий не могут быть просмотрены немедленно, материал следует заключить в поливиниловый спирт или заморозить, так как при комнатной температуре трофозоиты разрушаются через 30 мин. Исследуемый материал должен собираться в чистую сухую посуду, стерилизованную кипячением, так как вегетативные формы амеб весьма чувствительны к химическим веществам (дезсредствам).
Доставленный в лабораторию материал прежде всего подвергают макроскопическому осмотру. При осмотре отмечают консистенцию, наличие крови и слизи. В первую очередь подлежат исследованию неоформленные фекалии со слизью и кровью, так как в них есть основание предполагать наличие вегетативных форм амеб.
Практически у всех больных с острым амебным колитом реакция на скрытую кровь
положительна. Учитывая, что проведение этого теста несложное, его следует рекомендовать в тех случаях, когда вероятность диагноза амебной дизентерии высока, а в фекалиях больного макроскопически прожилки крови не определяются.
Жидкие кровянисто-слизистые фекалии могут быть исследованы без добавления физиологического раствора. В оформленных фекалиях обнаруживают только цисты, в таких случаях мазок приготавливают с добавлением физиологического раствора. Если больной обратился к врачу в период, когда у него функция кишечника нормальная и при исследовании обнаруживается малое количество цист, или они совсем не обнаруживаются при обычном исследовании, а есть основания предполагать, что расстройства кишечника в прошлом обусловлены паразитированием E.histolytica, применяются методы обогащения цист. Наиболее часто применяют метод отстаивания или метод центрифугирования (формалин-эфирного осаждения).
Характеристика вегетативных форм и цист E.histolytica в нативных мазках приведена в разделе “Морфология”.
В свежих, окрашенных раствором Люголя, препаратах вегетативные формы теряют подвижность, приобретая круглую форму. Цитоплазма окрашивается в коричневый цвет. Если ядро располагается близко к поверхности, его можно заметить в виде кольца, окрашенного в более светлый цвет, чем цитоплазма. В центре маленькая кариосома в виде блестящей точки.
В препаратах, окрашенных раствором Люголя, цисты правильной круглой формы, иногда овальные, с гладкой оболочкой желтого со светло-коричневым оттенком цвета. Размеры цист 10-15 мкм. Мелкозернистая цитоплазма окрашивается в равномерный золотисто-коричневый цвет, видны ядра: одно или два в незрелых цистах и четыре – в зрелых.
Для правильного подсчета ядер необходимо непрерывно вращать микровинтом, так как ядра редко лежат в одной плоскости. Ядра правильной круглой формы с тонким ободком и точечной кариосомой в центре. Гликогеновая вакуоль окрашивается в светло-бурый цвет, она имеет расплывчатые контуры и не резко отграничена от цитоплазмы.
Исследование свежих препаратов (нативный препарат и окрашенный раствором Люголя) должно применяться при каждом анализе на простейшие кишечника.
В некоторых случаях для уточнения морфологических признаков обнаруженных амеб пользуются методом исследования постоянных, окрашенных железным гематоксилином по Гайденгайну, препаратов.
Вегетативные формы дизентерийной амебы в препаратах, окрашенных по Гайденгайну, хорошо выделяются на фоне многочисленных эритроцитов, отдельных лейкоцитов и бактерий. Размеры трофозоитов варьируют от 12-25 до 22-45 мкм в диаметре, в среднем около 23 мкм.
Форма амеб вытянутая, часто округлая, в большинстве случаев хорошо обнаруживается светло-серая гомогенная эктоплазма и мелкозернистая темно-серая эндоплазма. Ядро круглое, пузырьковидное, с темной оболочкой, под которой в один слой располагаются мелкие, одинаковой величины, правильной формы зернышки периферического хроматина.
В мелких просветных формах дизентерийной амебы при окраске по Гайденгайну, зерна периферического хроматина нередко образуют серповидное скопление под ядерной оболочкой, что отличает его от ядра тканевой формы.
Цисты при окраске железным гематоксилином имеют общий вид и размеры такие же, как и окрашенные раствором Люголя. В одном и том же препарате могут быть обнаружены незрелые одно- и двуядерные цисты и зрелые четырехядерные. Размеры ядер в цистах различной степени зрелости неодинаковые : в одноядерных цистах ядро крупное (3-5 мкм), в двуядерных ядра средней величины (2-4 мкм), в четырехядерных – самые мелкие (2-3 мкм).
Как и в ядрах тканевых форм зерна периферического хроматина также располагаются под ядерной оболочкой тонким равномерным слоем. В цитоплазме многих цист обнаруживаются хроматоидные тела в виде коротких толстых палочек с закругленными концами. В наибольшем количестве они содержатся в одноядерных цистах, в наименьшем – в четырехядерных.
Можно производить окраску препаратов фекалий ускоренным методом по Гурвичу: на фиксированный мазок наливают 3% раствор железоаммиачных квасцов и подогревают до появления паров, споласкивают в дистиллированной воде , наливают на стекло гематоксилин и также нагревают до появления паров, снова споласкивают в дистиллированной воде и дифференцируют обычным методом в 1,5-2% железоаммиачных квасцах, затем промывают в проточной воде, проводят через спирты, ксилол, заключают в канадский бальзам.
2.8. Дифференциальная диагностика E.histolytica от E.coli:
1. В цитоплазме вегетативной формы E.coli вакуоли заполнены большим количеством бактерий, пищевого детрита и грибов. Цитоплазма грубоячеистая, разграничение ее на эктоплазму и эндоплазму обычно незаметное. Движение кишечных амеб крайне вялое, почти незаметное.
В неокрашенных препаратах у кишечных амеб в отличие от E.histolytica обнаруживаются ядра пузырьковидной формы. Под оболочкой ядра в виде отдельных глыбок неодинаковой величины и различной формы располагаются зерна периферического хроматина. Кариосома круглая, крупнее, чем у E.histolytica, располагается экцентрично.
2. Цисты E.coli по форме не отличаются от цист дизентерийной амебы, однако овальные среди них встречаются гораздо чаще. Размеры цист более крупные – 10-30 мкм (в среднем 18 мкм), незрелые цисты обычно двуядерные, зрелые – восьмиядерные. Ядра круглые, реже овальные, крупноточечная кариосома располагается в них эксцентрично.
При окраске с раствором Люголя в незрелых цистах обнаруживается резко контурированная темно-бурая гликогеновая вакуоль, оттесняющая цитоплазму и ядра на периферию. Хроматоидные тела имеют вид относительно длинных тонких темных палочек, с заостренными или оскольчатыми концами.
В связи с установленными недавно двумя видами дизентерийной амебы обнаружение в препарате фекалий только цист и/или просветных вегетативных форм (при отсутствии гематофагов) не является основанием для диагноза “амебная дизентерия” – это вероятнее всего недифференцированный “амебиаз” или цистоносительство (лабораторный диагноз: E.histolytica/E.dispar).
Применение рентгенологических методов исследования кишечника, особенно с использованием бария для диагностики инвазивного амебного колита не рекомендуется из-за риска перфорации кишечника и неспецифичности признаков, обнаруженных в случае “амебом”. Очень точным методом верификации диагноза амебного колита является колоноскопия с биопсией язвенных поражений.
Серологические тесты на противоамебные антитела дают положительные результаты приблизительно в 75% случаев инвазивного амебиаза с локализацией в толстой кишке. Серологическая диагностика весьма информативна для дифференцирования E.dispar от E.histolytica:
при инфекции E.dispar специфические антитела не образуются, в отличие от инфекции, вызванной E.histolytica, при которой даже асимптомные носители являются серопозитивными. К наиболее распространенным методам серологической диагностики относятся РНГА, РЭМА, РНИФ, ВИЭ и РИД.
Среди последних современных методов диагностики амебного колита применяют выявление Аг E.histolytica в фекалиях или в сыворотке с помощью моноклональных антител; обнаружение паразитарной ДНК при помощи ПЦР. Определение разницы в эпитопах при выделении галактоз-ингибирующего-адгезивного лектина позволяет отдифференцировать морфологические сходные между собой E.histolytica от E.dispar.
В случае внекишечного амебиаза исследование фекалий, как правило, дает отрицательный результат. Для постановки диагноза необходимо комплексное инструментальное обследование с учетом специфической локализации поражения, обусловленного E.histolytica. К сожалению, пункция и дренирование полости абсцесса с целью получения материала для исследования, как правило, малоинформативна, так как в таком материале обычно не находят возбудителя амебиаза.
1. Обязательное проведение УЗИ брюшной полости. При получении отрицательного ответа – желательна КТ или сцинтиграфия печени. Если результат отрицателен – предполагать другой диагноз.
2. В случае получения положительного результата от инструментальных методов диагностики – дополнительно серологическое исследование на наличие специфических антител. Противоамебные антитела удается выявить в сыворотках 95% больных с амебным абсцессом печени.
Выявление специфических антител позволяет назначать специфическую амебоцидную терапию.
3. Если выявлены определенные изменения при УЗИ или сцинтиграфии печени, а серология отрицательна – возможны 3 варианта: а) повторное серологическое исследование через 7 дней; б) исключение эхинококкоза печени или гепатомы; в) назначение аспирационной пункции для исключения пиогенного абсцесса печени.
Последний шаг проводят тонкой иглой под контролем УЗИ или КТ, что весьма опасно, так как возможно инфицирование полости абсцесса или попадание в эхинококковую кисту, с развитием анафилактического шока и диссеминации дочерних сколексов. Для предотвращения таких осложнений необходимо учитывать эпидемиологические факторы риска, серологические данные и наличие кальцификации.
Все вышесказанное подтверждает значимость серологических исследований для выявления внекишечных форм амебиаза. Однако, как и любой другой метод исследования, он имеет свои ограничения. Так в высокоэндемичных районах положительные серологические тесты могут быть обусловлены перенесенной в прошлом инфекцией. Более специфичным является выявление антигена или паразитарной ДНК.
Следует помнить о том, что в некоторых регионах нашей страны пока нет соответствующих условий для проведения серологических исследований. В таких случаях при обоснованном подозрении на амебный абсцесс печени рекомендуется начать лечение объемного процесса в печени ex juvantibus.
2.9. Лечение
П
репаратом выбора для лечения инвазивного амебиаза следует считать препарат группы нитроимидазолов типа метронидазола.
Эметин и его синтетическое производное дегидроэметин в связи со своей токсичностью в настоящее время применяется значительно реже. Описано множество побочных эффектов от их применения, среди них : мышечная слабость, боли в ногах, гипотензия, тахикардия, инверсия зубца T на ЭКГ, развитие застойной кардиомиопатии.
Хлорохин или делагил эффективен только для лечения амебного абсцесса печени. Применяемое некоторыми клиницистами сочетание делагила с метронидазолом для лечения амебного абсцесса печени не выявило каких-либо преимуществ против использования одного метронидазола.
Рекомендуемые схемы лечения больных различными формами амебиаза представлены в таблице 1
Таблица 1
Схемы лечения больных с инвазивным амебиазом
| Формы инфекции | Схемы лечения и дозы рекомендуемых препаратов |
| кишечная инфекция с умеренной клиникой | дилоксанида фуроат по 500 мг х 4 в день х 10 дней, перорально; парамомицин по 30 мг/кг в день, перорально в 3 приема х 10 дней; |
| тяжелый инвазивный колит | метронидазол по 750 мг х 3 в день, перорально или по 500 мг в/в х 4 в день х 10 дней; |
| при непереносимости метронидазола | тетрациклин по 250 мг х 4 в день, перорально х 10 дней; эритромицин по 500 мг х 4 в день, перорально х 10 дней; |
| амебный абсцесс печени | метронидазол по 750 мг х 3 в день, перорально х 10 дней или по 500 мг в/в х 4 в день х 10 дней или по 2,4 г в день, перорально х 1-2 дня; |
Эффективность применения дилоксанида фуроата и паромомицина при кишечном амебиазе обусловлена их хорошей переносимостью и практически полным невсасыванием в кровь. Могут быть рекомендованы детям и беременным.
Применение антибиотиков показано в случае непереносимости метронидазола и при развитии перфорации кишечника с перитонитом.
Обычно на 3-5 день лечения трихополом в случае внекишечного амебиаза у больных нормализуется температура тела, уменьшаются боли в пораженных органах. Если в течение 3-х дней не наступает улучшение и выявлены множественные абсцессы – рекомендована аспирация полости абсцесса с пролонгированным курсом трихопола на 2-3 недели.
В последнее время широко применяются сходные с трихополом тинидазол (фазижин, тридазол
) и орнидазол
.
Недавно очень хорошо зарекомендовал себя новый препарат нитрофуранового ряда макмирор
или нифуротел
ь. Его назначают по 2 таблетке х 2 в день х 10 дней. На прием препарата практически не выявлено никаких побочных действий, в связи с чем он был рекомендован в детской практике.
2.10. Эпидемиология
И
сточником инфекции при амебиазе является человек, выделяющий цисты E.histolytica. Выделение цист происходит неравномерно. Во внешней среде цисты погибают не сразу после выделения. В фекалиях они сохраняют жизнеспособность около 2-х недель при температуре 13-17° С.
Повышение температуры укорачивает срок жизнеспособности цист – при 37° С они сохраняются во внешней среде не более одних суток. При низкой температуре они, наоборот, не гибнут, например, при – 21° С они остаются живыми до 100 дней. Последнее обстоятельство объясняет обнаружение случаев амебиаза даже в условиях весьма холодного климата.
Механизм инфицирования – фекально-оральный, основными факторами передачи цист дизентерийной амебы являются пищевые продукты, реже – почва, мухи, вода, контаминированная цистами. В последнее время не исключается половой путь передачи амеб среди партнеров-гомосексуалистов.
Условия быта, водоснабжения, санитарное состояние населенных пунктов и общий культурный уровень населения могут определять различную степень пораженности. Население города, как правило, поражено в меньшей степени, чем сельское. В последнее время растет инфицированность E.histolytica среди школьников.
Так же как носительство, заболеваемость острым амебиазом регистрируется по всему земному шару, но, в отличие от носительства, наблюдается явная приуроченность болезни к зонам с жарким и сухим климатом. Особенности эпидемического процесса при амебиазе в какой-то степени могут быть связаны с ослаблением сопротивляемости организма, которое легче возникает в условиях жаркого климата.
Заболеваемость острым амебиазом, как правило, не носит характер эпидемических вспышек, почти всегда отдельные заболевания возникают без видимой связи между собой. Эпидемические вспышки развиваются обычно в результате попадания в воду нечистот. В последнее время описаны эпидемические вспышки в закрытых коллективах, в частности, среди заключенных в колониях строгого режима.
Различают определенные факторы риска, предрасполагающие к возникновению амебиаза и тяжелому его течению. Основные преморбидные факторы, способствующие развитию инвазивного амебиаза, представлены в таблице 2.
Таблица 2
| Риск инфицирования E.histolytica | Риск тяжелого инвазивного амебиаза |
| скученность в месте проживания | детский возраст, особенно новорожденные |
| отсутствие генерализованного водоснабжения | беременность и послеродовый период |
| иммиграция из эндемичных районов | применение кортикостероидов |
| умственная отсталость | наличие опухолей |
| промискуитет среди мужчин-гомосексуалистов | хроническое недоедание |
2.11. Профилактика
О
сновным подходом к профилактике амебиаза является улучшение жилищных условий и повышение уровня образования в тех странах, где распространен амебиаз. Более конкретно методы вмешательства должны быть направлены на:
улучшение водоснабжения, в частности на улучшение санитарного состояния окружающей среды и повышение безопасности пищевых продуктов;
раннее выявление и лечение инфекции и/или болезни;
санитарное просвещение.
Цисты E.histolytica чрезвычайно устойчивы к химическим дезинфицирующим средствам, в том числе к препаратам хлора, и могут выживать при разных уровнях pH и осмотического давления. Они быстро погибают при нагревании (примерно до 55° С), поэтому в эндемичных регионах лучше рекомендовать пить не хлорированную, а кипяченную воду.
Если это по каким-либо причинам невозможно, следует употреблять для питья только воду в закрытых бутылках. В связи с возможной контаминацией цистами дизентерийной амебы пищевых продуктов, в частности, фруктов и овощей, лучше употреблять в пищу только термически обработанные продукты и фрукты с сохранившей целостность оболочкой.
Раннее выявление цистоносителей и санирование их препаратами типа дилоксанида фуроата или метронидазола предотвращает риск передачи инфекции. В последнее время высказываются оптимистические предположения о создании еще в конце этого века эффективной вакцины против E.histolytica, которую можно будет применять в эндемичных по амебиазу регионах.
Частью общей программы просвещения, направленного на борьбу с передаваемыми фекально-оральным путем инфекциями, должно стать санитарное просвещение матерей, школьников и лиц, пользующихся влиянием среди населения. Путем периодических кампаний с использованием средств массовой информации следует пропагандировать соблюдение элементарных гигиенических навыков и постоянно усиливать мероприятия в этом направлении в школах, центрах медико-санитарной помощи и по месту жительства населения.
Заключение
А
мебиаз – одна из наиболее актуальных проблем здравоохранения. Современные особенности путешествий (облегчение туристических выездов для большинства населения нашей страны), увеличившаяся в последние годы иммиграция и наличие огромной массы людей, находящихся под высоким риском заболеваемости и смертности от этой инфекции, делают необходимым для врачей любых специальностей иметь полную осведомленность об эпидемиологии, клинике, диагностике и лечении инфекции, вызванной E.histolytica.
Можно отметить, что благодаря успехам медиков и биологов стали известны способы лечения и профилактики многих болезней, причиной которых являются простейшие паразиты. Разработаны новые препараты и методики, основанные на результатах исследования этих простейших; шанс на выздоровление получили больные, лечение которых ранее было проблематично или вообще невозможно.
Продолжение исследований в данной области, как фундаментальных, так и прикладных, открывает новые перспективы увеличения количества болезней поддающихся излечению, а также улучшению уже имеющихся способов терапии известных паразитарных заболеваний.
Библиографический список
1. Амебиаз и борьба с ним. // Бюллетень ВОЗ – 1985, №3, с.1-9.
2. Гинецинская Т.А., Добровольский А.А. Частная паразитология. Москва, “Высшая школа”, 1978,302 с.
3. Горбунова Ю.П. Лабораторная диагностика кишечных протозоозов. //ЦИУВ, Москва, 1989, 34 с.
4. Лейтман М.З. Амебиаз, кокцидиоидоз и балантидиаз. Ташкент, “Медицина”, 1968, 186 с.
5. Ляшенко Ю.И., Иванов А.И. Смешанные инфекции. Москва, “Медицина”, 1989, 235 с.
6. Павлова Е.А. Амебиаз. //ЦИУВ, Москва, 1980, 34 с.
7. Руководство по тропическим болезням. Амебиаз. //Под ред. А.Я.Лысенко., 1983.
8. Акимушкин И.И. Мир животных: Беспозвоночные. Ископаемые животные. – М.: Мысль, 1998. – 382 с.
9. Карузина И.П. Биология. – М.: Медицина, 1972 – 352 с.
10. Популярная медицинская энциклопедия. Гл. ред. В.И. Покровский – 3-е изд. – В одном томе. – М.: Советская энциклопедия, 1991 – 688 с.
11. Шахмирданов А.З. Курс лекций, прочитанный в ММУ №30 [на правах рукописи] 2000 г.
Вулнузан – популярный противовоспалительный и дезинфицирующий препарат из болгарии
Препарат природного происхождения из Болгарии, создан на основе щелочи Поморийского озера и содержит ряд важных для организма человека макро- и микроэлементов. Оказывает противовоспалительное и дезинфицирующее действие, угнетая патогенную бактериальную флору, стимулирует иммунобиологические защитные реакции – фагоцитоз и образование антител, стимулирует регенерацию тканей и эпителизацию раневых поверхностей.
Показания к применению Вулнузана: в комплексном лечении гнойных ран различного происхождения: инфицированные, хирургические поверхностные гнойные процессы, в том числе параректальные и постинъекционные абсцессы, трофические язвы, посттравматические и атеросклеротические раны, медикаментозная мацерация кожи, изъязвления кожи при болезни Бюргера, варикозные язвы, эрозия шейки матки, трещины соска молочной железы.
Способ применения и дозы.Местно, наружно. Мазь наносят непосредственно на рану или на марлю в количестве, достаточном для покрытия раневой поверхности, слоем толщиной 2-3 мм. Разовая доза – не более 10-15 г мази (при глубоких абсцессах). В начале лечения наносят мазь ежедневно, при стихании воспалительного процесса и появлении грануляционной ткани – через день.
При лечении трещин соска молочной железы мазь наносят несколько раз в день после кормления ребенка. Перед началом следующего кормления препарат тщательно смывают теплой кипяченой водой. При лечении эрозии шейки матки используют тампон с нанесенным на него препаратом, который вводят один раз в день, предпочтительно вечером, в течение 10-15 дней.
Галитоз: современные представления об этиологии и патогенезе (сообщение i)
© ГАЛОНСКИЙ В. Г., ТАРАСОВА Н. В., ШУШАКОВА А. А., БРИЛЬ Е. А., ТУМШЕВИЦ В. О.
УДК 616.314:616.314.18 – 002.4 – 02 – 092
ГАЛИТОЗ: СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ ОБ ЭТИОЛОГИИ И ПАТОГЕНЕЗЕ (СООБЩЕНИЕ I)
В. Г. Галонский, Н. В. Тарасова, А. А. Шушакова,
Е. А. Бриль, В. О. Тумшевиц Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого, ректор – д.м.н., проф. И.П. Артюхов; кафедра стоматологии детского возраста, зав. – д.м.н., доц. Е.А. Бриль;
НИИ медицинских проблем Севера СО РАМН, Красноярск, директор – чл.-
корр. РАМН, проф. В. Т. Манчук.
Резюме. В обзоре представлены данные о распространенности галитоза в различных странах мира, современные сведения о классификации, этиологии и патогенезе неприятного запаха изо рта.
Ключевые слова: галитоз, неприятный запах изо рта.
Галонский Владислав Геннадьевич – д.м.н., ассистент каф. стоматологии детского возраста КрасГМУ, ведущий научный сотрудник НИИ медицинских проблем Севера СО РАМН, е-mail: vladlime@mail.ru.
Тарасова Наталья Валентиновна – к.м.н., доцент каф. стоматологии детского возраста КрасГМУ; е-mail: tarasovastom@mail.ru.
Шушакова Анжелика Андреевна, врач – интерн кафедры стоматологии ИПО КрасГМУ; e-mail: ANNA_2021@mail.ru.
Неприятный запах изо рта наиболее часто обозначается термином – галитоз, кроме того в научной литературе встречаются такие понятия как озостомия и стоматодисодия. В тех случаях, когда появление неприятного запаха связано с заболеваниями полости рта, носа, глотки, верхних отделов желудочнокишечного тракта применяется термин «foetor oris» или «foetor ex ore». Если неприятный запах изо рта обусловлен выдыхаемым воздухом при заболеваниях легких, наиболее подходящим будет термин «галитоз» (от лат. halitus – выдох) [1, 3, 4, 35, 43].
Распространенность галитоза в странах Европы составляет 50-65%. В Германии данная нозология встречается у 66,7% населения, в США озостомией страдают 10-30% населения страны. Распространенность неприятного запаха изо рта у детей Турции составляет 14,5% и напрямую зависит от возраста, уровня гигиены полости рта и интенсивности кариозного процесса твердых тканей зубов [5, 22, 24, 27].
В целом неприятный запах изо рта встречается у 80-90% взрослого населения планеты, занимая третье место по распространенности после кариеса зубов и заболеваний тканей пародонта. Однако лишь в 25% случаев галитоз носит стойкий характер и обусловлен наличием хронических патологических очагов в организме индивидуума, чаще всего неприятный запах изо рта ассоциирован с пониженной саливацией полости рта в ночное время и употреблением определенных видов пищи. В связи с этим в современной классификации выделяют истинный галитоз и псевдогалитоз (галитофобию) [56]. Истинный галитоз может быть физиологическим, периодически проявляющимся в течение жизни, легко корректирующимся с помощью гигиены полости рта, и патологическим, устойчивым не устраняющимся традиционными средствами профилактики и гигиены. [13, 18, 20, 36, 43].
Истинный патологический галитоз – полиэтиологичное заболевание, обусловленное интраоральными и экстраоральными причинами. Интраоральные факторы неприятного запаха изо рта локализованы в полости рта и ротоглотке, проявляются в виде налета на языке, гингивита, пародонтита, фарингита, тон-
зиллита. Среди экстраоральных причин неприятного запаха выделяют патологии верхних дыхательных путей, желудочно-кишечного тракта, заболевания печени и почек [2, 8, 12, 53].
Галитоз может быть следствием приема лекарственных препаратов, вызывающих ксеростомию. Среди них наиболее распространены диметил сульфоксид, дисульфирам и изорбида динитрат [39].
Проблема галитоза занимает умы ученых уже не первое десятилетие. Так, T. Ferris (1927) считал, что неприятный запах это следствие взаимодействия продуктов переваривания, метаболизма, брожения и внутриротового гниения пищевых остатков, а также экскреции слюны, обладающей неприятным запахом. R. H. Brening, еще в 1939 г. выделил три первичных источника образования неприятного запаха: полость рта, легкие и верхние дыхательные пути. В полости рта, причиной может быть изменение консистенции и скорости секреции слюны, кариес зубов, разложение частиц пищи между зубами, на языке и в криптах миндалин, заболевания маргинального пародонта, гнойно-некротические процессы в мягких тканях. В верхних дыхательных путях причиной могут быть хронический тонзиллит, хронические синуситы, атрофический ринит, распадающиеся опухоли челюстно-лицевой области [9]. По мнению G. F. Sulser с со-авт. (1940), неприятный запах изо рта вызывается исключительно местными факторами, такими, например, как состав слюны [11, 44].
Ряд исследователей проводили экспериментальное моделирование чесночнолукового запаха для изучения патогенеза и клинической картины галитоза. Так,
H. Stallard в 1927 г., выявил, что жевание чеснока оставляло неприятный запах в полости рта на 72 часа, а проглатывание чеснока в капсулах портило дыхание на 48-60 часов. M. A. Blakenhorn и C. E. Richards (1936) экспериментально доказали, что запах чеснока и лука переноситься кровью в легкие, откуда выделяется с выдыхаемым воздухом, и отнюдь не является причиной пищевых частиц, оставшихся в полости рта. Однако данная теория нашла своих противников, так
H. W. Haggard и L. A. Greenberg (1935) утверждали, что «луковое» и «чесночное» дыхание возникает исключительно только благодаря остаткам пищевых
частиц в полости рта, кроме того, они экспериментально доказали, что полоскания водой с хлорамином полностью устраняют неприятный запах изо рта [9].
На сегодняшний день выдвинут ряд теорий патогенеза неприятного запаха изо рта. J. Tonzetich (1977) первым сообщил, что неприятный запах изо рта образуется в результате смешивания выдыхаемого воздуха с летучими сернистыми соединениями при его прохождении через ротовую полость, а также о связи неприятного запаха с сернистыми соединениями, а не с аминами и аммиаком как считалось ранее. Летучие сернистые соединения образуются в полости рта в результате гнилостного воздействия анаэробных микроорганизмов на эндогенные и экзогенные биологические субстраты, включающие слущенный эпителий, лейкоциты, слюну, кровь и остатки пищи, содержащие различные виды гликопротеидов, которые расщепляются под воздействием фермента – ß-галактозидазы [22, 25, 48, 50, 52, 57].
Множество исследователей выдвигает микробную теорию возникновения галитоза. Согласно исследованиям M. C. Solis-Gaffar с соавт. (1979) за образование неприятного запаха из 14 основных представителей микрофлоры полости рта ответственны только 4 вида грамотрицательных бактерий. Важную роль в этом процессе играют анаэробные бактерии рода Fusobacterium и Bacteroides, которые содержатся в высокой концентрации в поддесневом зубном камне и продуцируют гнилостные летучие вещества. Среди этих бактерий наиболее активны: Porphyromonas gingivalis, Treponema denticola и Bacteroides forsythus. Данные представители микрофлоры полости рта способны разлагать некоторые аминокислоты (цистеин, метионин, триптофан, лизин и др.) до пахучих веществ (сероводород, метилмеркаптан, диметилсульфид, индол, скатол, пут-ресцин и кадаверин. T. Takeshita и др. (2021) в своих исследованиях пришли к выводам о причастности к неприятному запаху изо рта микроорганизмов, принадлежащих разновидностям Streptococcus, Granulicatella, Rothia и Treponema. Другие исследования говорят о положительной корреляции между количеством фузобактерий в полости рта и уровнем ЛСС (летучих сернистых соединений) [6, 14, 20, 21, 23, 29, 30, 32, 34, 37, 38, 45, 46, 51].
K. Yaegaki и K. Sanada (1992), использовавшие в своих исследованиях метод газовой хроматографии, выявили, что большую роль в образовании неприятного запаха играет налет на спинке языка. Выявлена прямо пропорциональная зависимость между количеством Treponema denticola и Fusobacterium nucleatum в налете со спинки языка, органолептическими показателями галитоза и концентрацией летучих сернистых соединений в выдыхаемом воздухе. Это обусловлено анатомическими особенностями строения языка (нитевидные, грибовидные и листовидные сосочки, трещины и крипты, деятельность слюнных желез и языковых миндалин), что создает благоприятные условия для ретенции слу-щенного эпителия и остатков пищи и последующего скопления бактерий [16,
33, 40, 55].
I. Violet с соавт. (2007) в своих исследованиях обнаружил специфичные для пациентов, страдающих галитозом, микроорганизмы в налете спинки языка разновидности Streptococcus moorei, которые отсутствовали у пациентов без гали-тоза, что в дальнейшем может использоваться как в диагностических, так и в лечебных целях. Увеличение бактериального налета на языке, а также ношение съемных зубных протезов из акриловой пластмассы способствует увеличению уровня галитоза [54, 58].
Зачастую неприятный запах изо рта является сопутствующим симптомом заболеваний пародонта и сдвигает рН полости рта в щелочную сторону. Пациенты с заболеваниями пародонта чаще страдают галитозом, к тому же имеется прямая корреляционная зависимость между тяжестью патологии и уровнем летучих сернистых соединений в выдыхаемом воздухе. У таких пациентов это объясняется большим скоплением слущенного эпителия и микроорганизмов в полости рта, высокой концентрацией биологических субстратов, таких как кровь, десневая жидкость и гнойное отделяемое пародонтальных карманов [38, 40]. Однако некоторые исследования свидетельствуют об отсутствии взаимосвязи галитоза с заболеваниями пародонта. Данное расхождение мнений можно объяснить разными условиями их проведения. Исследования in vitro на грамот-рицательные анаэробные бактерии показали, что многие из них могут продуци-
ровать неприятный запах, но неизвестно какие именно микроорганизмы играют важную роль in vivo [7, 21, 28, 29, 32, 41, 47, 49, 55].
M. D. Levitt с соавт. в 1999 году выдвинули другую теорию происхождения галитоза. Согласно ей микрофлора кишечника продуцирует водород и метан -основные компоненты летучих сернистых соединений, которые затем поступают в кровоток и выводятся через легкие с воздухом [26].
Причиной возникновения хронического галитоза может стать триметилами-нурия – редкое нарушение обмена веществ, основным симптомом которого является хронический неприятный «рыбий» запах от тела. Выделяют наследственную и приобретенную триметиламинурию. В первом случае происходит мутация флавин-ассоциированного-монооксигеназного (FMO3) гена. Стоит отметить, данная наследственная патология достаточно редко встречается и проявляется у детей. В патогенезе приобретенной триметиламинурии важное значение имеют хронические заболевания печени. В обоих случаях данное патологическое состояние характеризуется выделением триметиламина, обладающего отвратительным запахом через биологические секреты организма, такие как пот, слюну и др. [10, 15, 17, 31].
Полиэтиологичность и связанные с этим различия стадий патогенеза галито-за создают проблему точной диагностики. На сегодняшний день остро необходима разработка простых и доступных методов диагностики галитоза, так как больные, предъявляющие жалобы на неприятный запах изо рта, в поисках причин этого состояния вынуждены обращаться ко многим врачам различных специальностей, идя «по кругу» от одного специалиста к другому: врач-стоматолог направляет такого пациента к терапевту, терапевт – к гастроэнтерологу, гастроэнтеролог – к отоларингологу, который направляет его вновь к стоматологу и др.
Значительные трудности возникают при лечении данной категории пациентов, так как до настоящего времени отсутствуют научно обоснованные дифференцированные лечебные рекомендации в отношении больных галитозом, а применение мятных таблеток, пастилок, спреев «для освежения дыхания»
обеспечивает минимальный эффект от нескольких минут до нескольких часов. Кратковременность действия освежающих препаратов, не способных устранить источник неприятного запаха, делает такое лечение не эффективным.
Галитоз – является серьезной медико-социальной проблемой, так как неприятный запах изо рта отрицательно влияет на качество жизни больного, снижая его социальную активность, вызывая хронический психологический стресс, при этом галитоз – одна из наиболее слаборазвитых областей в научной стоматологии и потребность в дальнейшем изучении этиологии, диагностики и лечения неприятного запаха изо рта очевидна [19, 41, 42].
V.G. Galonsky, N.V. Tarasova, A.A. Shyshacova, E.A. Bril, V.O. Tumshevits
Литература
1. Аврамова О. Г. Галитоз: новая проблема в стоматологии // Стоматология для всех. – 2004. – № 1. – С. 18-20.
2. Аврамова О. Г. Изучение галитоза у лиц с заболеваниями ЖКТ и полости рта // Институт стоматологии. – 2004. – № 4. – С. 86-87.
3. Международная статистическая классификация болезней и проблем, связанных со здоровьем. Десятый пересмотр. М. – 1995. – Т. 1, Ч. 2.
– С. 203.
4. Улитовский С. Б. Оценка степени выраженности галитоза // Дент Арт. – 2004. – № 4. – С. 27-28.
5. Amir E., Shimonov R., Rosenberg М. Halitosis in children // Pediatr. -1999. – Vol. 134, № 3. – Р. 338-343.
6. Berg M., Fosdick L. S. Studies in periodontal disease. Putrefactive organisms in the mouth // Dent. Res. – 1946. – Vol. 25. – P. 73.
7. Bosy A. Oral malodor: philosophical and practical aspects // Can Dent Assoc. – 1997. – Vol. 63. – P. 196-201.
8. Bosy A., Kulkarni G. V., Rosenberg M. et al. Relationship of oral malodor to periodontitis: evidence of independence in discrete subpopulations // Pe-riodontol. – 1994. – Vol. 65. – P. 37-46.
9. Brening R. H., Sulser G. F., Fosdick L. S. The determination of halitosis by the use of the osmoscope and the cryoscopic method // Dent Res. – 1939. -Vol. 18. – P. 127-132.
10. Chalmers R. A., Bain M. D., Michelakakis H. et al. Diagnosis and management of trimethylaminuria (FMO3 deficiency) in children // Inherit Metab Dis. – 2006. – Vol. 29. – P. 162-172.
11. De Jong M. H., Van Der Hoeven J. S. The growth of oral bacteria on saliva // Dent Res. – 1987. – Vol. 66. – P. 498-505.
12. Delanghe G., Ghyselen J., Van Steenberghe D. et al. Multidisciplinary breath-odour clinic // Lancet. – 1997. – Vol. 350. – P. 187.
13. Dreizen S., Gilley E. J., Spies T. D. A comparison of the prevailing cell types in saliva of persons with and without periodontal disease // Oral Surg. -1956. – Vol. 9. – P. 278.
14. Dzink J. L., Socransky S. S., Haffajee A. D. The predominant cultivable microbiota of active and inactive lesions of destructive periodontal diseases // Clin Periodontol. – 1988. – Vol. 15. – P. 316-322.
15. Feller L., Blignaut E. Halitosis: a review // SADJ. – 2005. – Vol. 60. – P. 17-19.
16. Garrett N. R. Poor oral hygiene, wearing dentures at night, perceptions of mouth dryness and burning, and lower educational level may be related to oral malodor in denture wearers // Evid Based Dent Pract. – 2021. – Vol. 10, № 1. – P. 67-69.
17. Gehan A., Alvin K. C., David Goudie R. et al. Trimethylaminuria (Fish-Odor Syndrome). A Case Report // Dermatology. – 2007. – Vol. 143. – P. 8184.
18. Goldberg S., Kozlovsky A., Gordon D. et al. Cadaverine as a putative component of oral malodor // Dent Res. – 1994. – Vol. 73. – P. 1168-1172.
19. Hawkins C. Real and imaginary halitosis // Br. Med. – 1987. – Vol. 294.
– P. 200-201.
20. Ishikawa M., Shibuya K., Tokita F. A study of bad breath: the evaluation of bad breath by methyl mercaptan production in the mouth rinse // Dent Health. – 1984. – Vol. 24. – P. 54-60.
21. Kenney E. B., Ash M. M. Oxidation-reduction potential of developing plaque, periodontal pockets and gingival sulci // Periodontol. – 1969. – Vol.
40. – P. 630.
22. Kleinberg I., Westbay G. Salivary and metabolic factors involved in oral malodor formation // Periodontol. – 1992. – Vol. 63. – P. 768-775.
23. Kleinberg I., Codipilly M., Rosenberg M. The biological basis of oral malodor formation. In: Bad breath: research perspectives // Tel Aviv University: Ramot. – 1995. – P. 13-39.
24. Leao A., Sheiham A. Relation between Clinical Dental Status and Subjective Impacts on Daily Living // DENT RES. – 1995. – Vol. 74. – P. 1408.
25. Levine M. The role for butyrate and propionate in mediating Helacells growth inhibition by human dental plaque fluid from adult periodontal disease // Oral Biol. – 1985. – Vol. 30. – P. 155.
26. Levitt M. D., Furne J., Springfield J. et al. Detoxification of hydrogen sulfide and methanethiol in the cecal mucosa // Clin Invest. – 1999. – Vol. 104.
– P. 1107-1114.
27. Liu X. N., Shinada K., Chen X. C. et al. Oral malodor-related parameters in the Chinese general population // Journal of clinical periodontology. – 2006.
– Vol. 33, № 1. – P. 31-36.
28. Loe H., Theilade E., Borglum-Jensen S. B. Experimental gingivitis in man // Periodontol. – 1965. – Vol. 36. – P. 177.
29. Loesche W. J. Importance of nutrition in gingival crevice microbial ecology // Periodontology. – 1968. – Vol. 6. – P. 245.
30. Loesche W. J., Kazor C. E. Microbiology and treatment of halitosis // Periodontology 2000. – 2002. – Vol. 28. – P. 256-279.
31. Marks R., Dudley F., Wan A. Trimethylamine metabolism in liver disease // Lancet. – 1978. – Vol. 1. – P. 1106-1107.
32. McNamara T. F., Alexander J. F., Lee M. The role of microorganisms in the production of oral malodor // Oral Surg. – 1972. – Vol. 34. – P. 41-48.
33. Miyazaki H., Arao M., Okamura K. et al. Tentative classification for halitosis patients and its treatment needs // Niigata Dent. – 1999. – Vol. 32. -P. 11-15.
34. Moore W. E. C., Holdeman L. V., Cato E. P et al. Comparative bacteriology of juvenile periodontitis // Infect Immun. – 1985. – Vol. 48. – P. 507519.
35. Muller K. M., Breuer M. Ubler Mundgeruch // Gastroenterologie. -1992. – P. 108-112.
36. Nal?aci R., Sönmez I. S. Evaluation of oral malodor in children // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. – 2008. – Vol. 106, № 3. -P. 384-388.
37. Pianotti R., Pitts G. Effects of an antiseptic mouthwash on odorigenic microbes in the human gingival crevice // Dent. Res. – 1978. – Vol. 57. – P. 175.
38. Simonson L. G., Goodman C. H., Bial Y. Y. et al. Quantitative relationship of Treponema denticola to severity of periodontal disease // Infect. Immun. – 1988. – Vol. 56. – P. 726-728.
39. Scully C. Drug effects on salivary glands // Oral Dis. – 2003. – Vol. 9. -P. 165-176.
40. Solis-Gaffar M. C., Fischer T. J., Gaffar A. Instrumental evaluation of odor produced by specific oral microorganisms // Soc. Cosmet. Chem. – 1979.
– Vol. 30. – P. 241.
41. Stamou E., Kozlovsky A., Rosenberg M. Association between oral malodour and periodontal disease-related parameters in a population of 71 Israelis // Oral Dis. – 2005. – Vol. 11. – P. 72-74.
42. Suarez F. L., Fume J. K., Springfield J. et al. Morning breath odor: influence of treatments on sulfur gases // Dent Res. – 2000. – Vol. 79. – P. 17731777.
43. Sulser G. F., Brening R. H., Fosdick L. S. Some conditions that affect the odor concentration of breath // Dent Res. – 1939. – Vol. 18. – P. 355-359.
44. Sulser G. F., Lesney T. A., Fosdick L. S. The reduction in breath and mouth odors by means of brushing the teeth // Dent. Res. – 1940. – Vol. 19. -P. 173.
45. Persson S., Edlund M. B., Claesson R. et al. The formation of hydrogen sulfide and methyl mercaptan by oral bacteria // Oral Microbiol Immunol. -1990. – Vol. 5. – P. 195-201.
46. Takeshita T., Suzuki N., Nakano Y.et al. Relationship between oral malodor and the global composition of indigenous bacterial populations in saliva // Applied and Environmental Microbiology. – 2021. – Vol. 9. – P. 28062814.
47. Tonzetich J., McBride B. C. Characterization of volatile sulphur production by pathogenic and non-pathogenic strains of oral bacteroides // Oral BioL.
– 1981. – Vol. 26. – P. 963.
48. Tonzetich J., Kestenbaum R. C. Odor production by human salivary fractions and plaque // Oral Biol. – 1969. – Vol. 14. – P. 815.
49. Tonzetich J., Eigen E., King W. J. et al. Volatility as a factor in the inability of certain amines and indole to increase the odor of saliva // Arch. Oral Biol. – 1967. – Vol. 12. – P. 1167-1175.
50. Tonzetich J. Production and origin of oral malodor: a review of mechanisms and methods of analysis // Periodontol. – 1977. – Vol. 48. – P. 13-20.
51. Traudt M., Kleinberg L. Bacteria in human dental plaque responsible for its oxygen uptake activity // Dent. Res. – 1988. – Vol. 67. – P. 204.
52. Van Der Hoeven J. S., Camp P. G. M. Synergistic degradation of mucin by Streptococcus oralis and Streptococcus sanguis in mixed chemostat cultures // Dent Res. – 1991. – Vol. 70. – P. 1041-1044.
53. Van Steenberghe D., Rosenberg M. Bad breath: a multidisciplinary approach // Leuven, Belgium: Leuven University Press. – 1996. – Vol. 14. – P. 1691.
54. Violet I. H., Zambon Joseph J., Prem K. Identification of oral bacterial species associated with halitosis // Am. Dent Assoc. – 2007. – Vol. 138. – P. 1113-1120.
55. Yaegaki K., Sanada K. Biochemical and clinical factors influencing oral malodor in periodontal patients // Periodontol. – 1992. – Vol. 63. – P. 783-789.
56. Yaegaki K., Coil J. M. Examination, classification and treatment of halitosis; clinical perspectives // Can. Dent Assoc. – 2000. – Vol. 66. – P. 257-261.
57. Yaegaki K., Sanada K. Volatile sulfur compounds in mouth air from clinically healthy subjects and patients with periodontal disease // Periodontal Res. – 1992. – Vol. 27, № 4. – P. 233-238.
58. Yasukawa T., Ohmori M., Sato S. The relationship between physiologic halitosis and periodontopathic bacteria of the tongue and gingival sulcus // Odontology. – 2021. – Vol. 98, № 1. – P. 44-51.







